proteínas de membrana
mientras que los lípidos son los elementos estructurales fundamentales de las membranas, las proteínas son responsables de llevar a cabo funciones específicas de la membrana. La mayoría de las membranas plasmáticas consisten en aproximadamente 50% de lípidos y 50% de proteínas en peso, con las porciones de carbohidratos de glicolípidos y glicoproteínas que constituyen 5 a 10% de la masa de la membrana. Dado que las proteínas son mucho más grandes que los lípidos, este porcentaje corresponde a aproximadamente una molécula de proteína por cada 50 a 100 moléculas de lípidos., En 1972, Jonathan Singer y Garth Nicolson propusieron el modelo de mosaico fluido de la estructura de la membrana, que ahora es generalmente aceptado como el paradigma básico para la organización de todas las membranas biológicas. En este modelo, las membranas se ven como fluidos bidimensionales en los que las proteínas se insertan en bicapas lipídicas (figura 12.3).

Figura 12.3
modelo mosaico Fluido de la membrana plasmática., Las proteínas integrales de la membrana se insertan en la bicapa lipídica, mientras que las proteínas periféricas se unen a la membrana indirectamente por interacciones proteína-proteína. La mayoría de las proteínas de membrana integrales son transmembranas (more…)
Singer y Nicolson distinguieron dos clases de proteínas asociadas a la membrana, que llamaron proteínas de membrana periféricas e integrales., Las proteínas periféricas de membrana se definieron operacionalmente como proteínas que se disocian de la membrana después de tratamientos con reactivos polares, como soluciones de pH extremo o alta concentración de sal, que no interrumpen la bicapa fosfolípida. Una vez disociadas de la membrana, las proteínas de la membrana periférica son solubles en tampones acuosos. Estas proteínas no se insertan en el interior hidrofóbico de la bicapa lipídica. En cambio, se asocian indirectamente con membranas a través de interacciones proteína-proteína., Estas interacciones frecuentemente involucran enlaces iónicos, que son interrumpidos por PH extremo o alto contenido de sal.
a diferencia de las proteínas de membrana periféricas, las proteínas de membrana integrales pueden liberarse solo mediante tratamientos que interrumpen la bicapa fosfolípida. Porciones de estas proteínas integrales de membrana se insertan en la bicapa lipídica, por lo que pueden disociarse solo por reactivos que interrumpen las interacciones hidrofóbicas., Los reactivos más utilizados para la solubilización de proteínas integrales de membrana son los detergentes, que son pequeñas moléculas anfipáticas que contienen tanto grupos hidrofóbicos como hidrofílicos (figura 12.4). Las porciones hidrofóbicas de los detergentes desplazan los lípidos de la membrana y se unen a las porciones hidrofóbicas de las proteínas integrales de la membrana. Debido a que el otro extremo de la molécula detergente es hidrofílico, los complejos detergente-proteína son solubles en soluciones acuosas.

Figura 12.4
la Solubilización de las proteínas integrales de membrana por detergentes., Los detergentes (por ejemplo, octil glucósido) son moléculas anfipáticas que contienen grupos de cabezas hidrofílicas y colas hidrofóbicas. Las colas hidrofóbicas se unen a las regiones hidrofóbicas de la membrana integral(más…)
muchas proteínas integrales son proteínas transmembrana, que abarcan la bicapa lipídica con porciones expuestas a ambos lados de la membrana. Estas proteínas pueden ser visualizadas en micrografías electrónicas de membranas plasmáticas preparadas por la técnica de fractura por congelación (ver figura 1.35). En estas muestras, la membrana se divide y se separa en sus dos valvas., Las proteínas transmembranas son entonces aparentes como partículas en las caras internas de la membrana (figura 12.5).

figura 12.5
micrografía electrónica de fractura por congelación de membranas de glóbulos rojos humanos. Las partículas en la membrana son proteínas transmembrana. (Harold H. Edwards / Visuals Unlimited.,)
Las porciones que abarcan la membrana de las proteínas transmembranas son generalmente hélices α de 20 a 25 aminoácidos hidrofóbicos que se insertan en la membrana del retículo endoplasmático durante la síntesis de la cadena polipeptídica (ver figuras 9.11, 9.12 y 9.13). Estas proteínas son transportadas en vesículas de membrana desde el retículo endoplásmico al aparato de Golgi, y desde allí a la membrana plasmática., Los grupos de carbohidratos se agregan a las cadenas polipeptídicas tanto en el retículo endoplásmico como en el aparato de Golgi, por lo que la mayoría de las proteínas transmembranas de la membrana plasmática son glicoproteínas con sus oligosacáridos expuestos en la superficie de la célula.
Los estudios de glóbulos rojos han proporcionado buenos ejemplos de proteínas periféricas e integrales asociadas con la membrana plasmática. Las membranas de los eritrocitos humanos contienen alrededor de una docena de proteínas principales, que fueron identificadas originalmente por electroforesis en gel de preparaciones de membrana., La mayoría de ellas son proteínas de membrana periféricas que han sido identificadas como componentes del citoesqueleto cortical, que subyace a la membrana plasmática y determina la forma celular (Ver capítulo 11). Por ejemplo, la proteína de membrana periférica más abundante de los glóbulos rojos es spectrin, que es la principal proteína citoesquelética de los eritrocitos. Otras proteínas de la membrana periférica de los glóbulos rojos incluyen actina, anquirina y banda 4.1., La anquirina sirve como el enlace principal entre la membrana plasmática y el citoesqueleto al unirse tanto a la espectrina como a la banda 3 de la proteína integral de la membrana (ver figura 11.11). Un enlace adicional entre la membrana y el citoesqueleto es proporcionado por la banda 4.1, que se une a las uniones de la espectrina y la actina, así como a la glicoforina (la otra proteína de membrana integral principal de los eritrocitos).
las dos principales proteínas integrales de membrana de los glóbulos rojos, la glicoforina y la banda 3, proporcionan ejemplos bien estudiados de la estructura de la proteína transmembrana (figura 12.6)., La glicoforina es una pequeña glicoproteína de 131 aminoácidos, con un peso molecular de aproximadamente 30,000, la mitad de los cuales son proteínas y la mitad carbohidratos. La glicoforina cruza la membrana con una única hélice α de membrana de 23 aminoácidos, con su porción amino-terminal glicosilada expuesta en la superficie celular. Aunque la glicoforina fue una de las primeras proteínas transmembrana que se caracterizó, su función precisa sigue siendo desconocida. En contraste, la función de la otra proteína transmembrana importante de los glóbulos rojos es bien entendida., Esta proteína, originalmente conocida como banda 3, es el transportador de aniones responsable del paso de los iones bicarbonato (HCO3-) y cloruro (Cl-) a través de la membrana de los glóbulos rojos. La cadena del polipéptido de la banda 3 es 929 aminoácidos y se cree que tiene 14 regiones α-helicoidales que abarcan la membrana. Dentro de la membrana, los dímeros de la banda 3 forman estructuras globulares que contienen canales internos a través de los cuales los iones son capaces de viajar a través de la bicapa lipídica.
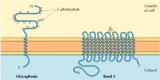
figura 12.6
proteínas integrales de membrana de los glóbulos rojos., La glicoforina (131 aminoácidos) contiene una única hélice α transmembrana. Está fuertemente gliocosilada, con oligosacáridos Unidos a 16 sitios en la porción extracelular de la cadena polipeptídica. (mas…)
debido a su carácter anfipático, las proteínas transmembrana han demostrado ser difíciles de cristalizar, como se requiere para el análisis estructural tridimensional por difracción de rayos X., La primera proteína transmembrana analizada por cristalografía de rayos X fue el Centro de reacción fotosintética de la bacteria Rhodopseudomonas viridis, cuya estructura fue reportada en 1985 (figura 12.7). El Centro de reacción contiene tres proteínas transmembrana, designadas L, M Y H (ligera, media y pesada) de acuerdo con sus tamaños aparentes indicados por electroforesis en gel. Las subunidades L y M tienen cada una Cinco hélices α que abarcan la membrana. La subunidad H tiene una única hélice α transmembrana, con la mayor parte de la cadena polipeptídica en el lado citosólico de la membrana., La cuarta subunidad del centro de reacción es un citocromo, que es una proteína de membrana periférica unida al complejo por interacciones proteína-proteína.

Figura 12.7
Un bacteriana centro de reacción fotosintética. El Centro de reacción consiste en tres proteínas transmembrana, designadas L (Rojo), M (amarillo) y H (Verde). Las subunidades L y M tienen cada una Cinco hélices α transmembrana, mientras que la subunidad H solo tiene (más…)
aunque la mayoría de las proteínas transmembrana abarcan la membrana por regiones α-helicoidales, este no siempre es el caso., Una excepción bien caracterizada es proporcionada por las porinas, una clase de proteínas que forman canales en las membranas externas de algunas bacterias. Muchas bacterias, incluyendo E. coli, tienen un sistema de membrana dual en el que la membrana plasmática (o membrana interna) está rodeada por la pared celular y una membrana externa distinta (figura 12.8). A diferencia de la membrana plasmática, la membrana externa es altamente permeable a iones y pequeñas moléculas polares (en el caso de E. coli, con pesos moleculares de hasta 600). Esta permeabilidad resulta de las porinas, que forman canales acuosos abiertos a través de la bicapa lipídica., Como se discutió en el Capítulo 10, las proteínas relacionadas con las porinas bacterianas también se encuentran en las membranas externas de las mitocondrias y los cloroplastos.
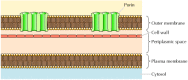
Figura 12.8
externa Bacteriana de las membranas. La membrana plasmática de algunas bacterias está rodeada por una pared celular y una membrana externa distinta. La membrana externa contiene porinas, que forman canales acuosos abiertos que permiten el paso libre de iones y pequeñas moléculas.
El análisis estructural ha indicado que las porinas no contienen regiones α-helicoidales hidrofóbicas., En cambio, cruzan la membrana como barriles β, en los que 16 hojas β se pliegan en una estructura similar a un barril que encierra un poro acuoso (figura 12.9). Las cadenas laterales de los aminoácidos polares recubren el poro, mientras que las cadenas laterales de los aminoácidos hidrofóbicos interactúan con el interior de la membrana. Los monómeros de porina se asocian para formar trímeros estables, cada uno de los cuales contiene tres canales abiertos a través de los cuales las moléculas polares pueden difundirse a través de la membrana.

Figura 12.9
la Estructura de una porina de monómero., Cada monómero es un barril β que consta de 16 filamentos β antiparalelos (flechas). El extremo superior de la molécula se enfrenta al medio externo. (De H. Nikaido, 1994. J. Biol. Chem. 269: 3905.)
en contraste con las proteínas transmembrana, una variedad de proteínas (muchas de las cuales se comportan como proteínas integrales de membrana) están ancladas en la membrana plasmática por lípidos o glicolípidos unidos covalentemente (figura 12.10). Los miembros de una clase de estas proteínas se insertan en el prospecto externo de la membrana plasmática mediante anclajes de glicosilfosfatidilinositol (GPI)., Los anclajes GPI se agregan a ciertas proteínas que han sido transferidas al retículo endoplásmico y están ancladas en la membrana por una región transmembrana C-terminal (ver figura 9.16). La región transmembrana se escinde a medida que se agrega el anclaje GPI, por lo que estas proteínas permanecen unidas a la membrana solo por el glicolípido. Dado que las cadenas polipeptídicas de proteínas ancladas a GPI se transfieren al retículo endoplásmico, se glicosilan y se exponen en la superficie de la célula después del transporte a la membrana plasmática.
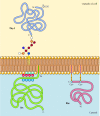
Figura 12.,10
ejemplos de proteínas ancladas en la membrana plasmática por lípidos y glicolípidos. Algunas proteínas (por ejemplo, la proteína de linfocitos Thy-1) están ancladas en la valva externa de la membrana plasmática mediante anclajes GPI añadidos a su terminal C En el retículo endoplasmático. (mas…)
otras proteínas están ancladas en el prospecto interno de la membrana plasmática por lípidos unidos covalentemente. En lugar de procesarse a través de la vía secretora, estas proteínas se sintetizan en ribosomas citosólicos libres y luego se modifican mediante la adición de lípidos., Estas modificaciones incluyen la adición de ácido mirístico (un ácido graso de 14 carbonos) al extremo amino de la cadena polipeptídica, la adición de ácido palmítico (16 carbonos) a las cadenas laterales de los residuos de cisteína, y la adición de grupos prenilo (15 o 20 carbonos) a las cadenas laterales de los residuos de cisteína carboxi-terminal (Véanse las figuras 7.29, 7.30 y 7.31). En algunos casos, estas proteínas (muchas de las cuales se comportan como proteínas de membrana periférica) son dirigidas a la membrana plasmática por regiones cargadas positivamente de la cadena polipeptídica, así como por los lípidos adjuntos., Estos dominios proteicos cargados positivamente pueden interactuar con los grupos de cabeza de fosfatidilserina cargados negativamente en la cara citosólica de la membrana plasmática. Es de destacar que muchas de las proteínas ancladas en el prospecto interno de la membrana plasmática (incluyendo las proteínas src Y Ras ilustradas en la figura 12.10) juegan un papel importante en la transmisión de señales desde los receptores de superficie celular a las dianas intracelulares, como se discute en el próximo capítulo.