una titulación es una técnica volumétrica en la que se agrega una solución de un reactivo (el valorante) a una solución de un segundo reactivo (el «analito») hasta que se alcanza el punto de equivalencia. El punto de equivalencia es el punto en el que el valorante se ha añadido exactamente en la cantidad correcta para reaccionar estequiométricamente con el analito (cuando moles de valorante = moles de analito). Si se colorea el valorante o el analito, el punto de equivalencia es evidente por la desaparición del color a medida que se consumen los reactivos., De lo contrario, se puede agregar un indicador que tenga un «punto final» (cambia de color) en el punto de equivalencia, o el punto de equivalencia se puede determinar a partir de una curva de titulación. La cantidad de valorante añadido se determina a partir de su concentración y volumen:
n (mol) = C (mol/L) * V (L)
y la cantidad de valorante se puede utilizar en el cálculo estequiométrico habitual para determinar la cantidad de analito.
el proceso de valoración se puede observar en el siguiente vídeo.,
Un volumen medido de la solución a titular, en este caso, incoloro acuosa de ácido acético, CH3COOH(aq) se coloca en un vaso de precipitados. El hidróxido de sodio incoloro NaOH (aq), que es el valorante, se agrega cuidadosamente por medio de una bureta. El volumen de valorante añadido se puede determinar leyendo el nivel de líquido en la bureta antes y después de la valoración. Esta lectura generalmente se puede estimar a la centésima de mililitro más cercana, por lo que se pueden hacer adiciones precisas de valorante rápidamente.,
a medida que los primeros mililitros de valorante fluyen en el matraz, algunos indicadores cambian brevemente a rosa, pero vuelven a incoloros rápidamente. Esto se debe a un gran exceso de ácido acético. El reactivo limitante NaOH se consume por completo.
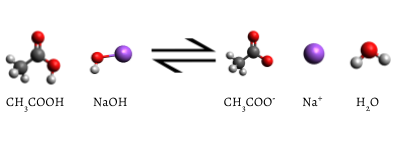
el indicador agregado cambia a rosa cuando se completa la titulación, lo que indica que todo el ácido acético acuoso ha sido consumido por NaOH(aq). La reacción que se produce es
\
Finalmente, todo el ácido acético se consume., La adición de incluso una fracción de una gota de valorante produce un color rosa duradero debido al NaOH no reaccionado en el matraz. El cambio de color que se produce en el punto final del indicador indica que todo el ácido acético se ha consumido, por lo que hemos alcanzado el punto de equivalencia de la titulación. Si se añadiera un poco más de solución de NaOH, habría un exceso y el color de la solución en el matraz se oscurecería mucho. El punto final aparece de repente, y se debe tener cuidado de no sobrepasar el punto final.
una vez que la titulación ha alcanzado el punto final, se lee un volumen final desde la bureta., Usando la lectura inicial y final, el volumen agregado se puede determinar con bastante precisión:
el objeto de una valoración es siempre añadir solo la cantidad de valorante necesaria para consumir exactamente la cantidad de sustancia que se valora. En la reacción de NaOH-CH3COOH Eq. \(\ref{2}\), el punto de equivalencia se produce cuando se ha añadido una cantidad molar igual de NaOH desde el cilindro graduado para cada mol de CH3COOH originalmente en el matraz de valoración., Es decir, en el punto de equivalencia la relación de la cantidad de NaOH, añadida a la cantidad de CH3COOH consumida debe ser igual a la relación estequiométrica
\
La titulación se utiliza a menudo para determinar la concentración de una solución. En muchos casos no es sencillo obtener una sustancia pura, pesarla con precisión y disolverla en un matraz aforado como se hizo en el Ejemplo 1 de concentraciones de solución. El NaOH, por ejemplo, se combina rápidamente con H2O y CO2 del aire, por lo que incluso una muestra recién preparada de NaOH sólido no será pura., Su peso cambiaría continuamente a medida que se absorbieran el CO2(g) y el H2O(g). El cloruro de hidrógeno (HCl) es un gas a temperaturas y presiones normales, por lo que es muy difícil de manejar o pesar. Las soluciones acuosas de ambas sustancias deben estandarizarse; es decir, sus concentraciones deben determinarse mediante titulación.
Con mucho, el uso más común de las titulaciones es para determinar incógnitas, es decir, para determinar la concentración o cantidad de sustancia en una muestra sobre la que inicialmente no sabíamos nada. El siguiente ejemplo implica un desconocido que muchas personas encuentran todos los días.,
los 308,0 mg obtenidos en este ejemplo concuerdan razonablemente con la afirmación del fabricante de 300 mg. Las tabletas son selladas por máquinas, no se pesan individualmente, por lo que se espera alguna variación.