US Pharm. 2020;45(9):27-29.
abstrakt: da syntetiske hormoner først blev kombineret i 1940 ‘ erne, er hormonerstatningsterapi blevet anvendt i vid udstrækning af kvinder, der oplever uønskede menopausale symptomer. Efterfølgende forskning førte til opdagelser af flere negative effekter forbundet med brugen af hormonbehandling, hvilket udløste diskussioner om risiciene i forhold til fordelene ved hormonbehandling., På grund af de risici, der er forbundet med kommercielle præparater, er sammensat hormonbehandling (CHT) blevet mere fremtrædende, da det er blevet udråbt som et biologisk ækvivalent alternativ til syntetiske hormoner. Men, på grund af minimal til ingen FDA tilsyn i sammensætningen realm generelt, CHT kan ikke være så sikker som er blevet annonceret. I 2018, baseret på gunstige forsøgsresultater, blev Bijuva den første FDA-godkendte bioidentical kombination 17-beta estradiol-progesteronformulering.,
i årtier har kvinder henvendt sig til hormonerstatningsterapi for at behandle uønskede vasomotoriske symptomer forbundet med overgangsalderen, såsom hetetokter og nattesved. Kvinder kan bruge op til en tredjedel af deres liv i en hormon-mangelfuld tilstand, hvilket yderligere bidrager til, at sådanne uønskede virkninger som humørsvingninger, øget risiko for osteoporose, og nedsat libido. Systemisk østrogen er den mest effektive behandling for vasomotoriske symptomer, mens genitourinære symptomer forbundet med overgangsalderen bør behandles med lavdosis topisk østrogen.,1 observationsundersøgelsen af kvinders sundhed i hele nationen fandt, at kvinder oplever vasomotoriske symptomer i gennemsnit 7, 4 år efter overgangsalderen.2 de fleste klinikere anbefaler dog, at behandlingen ikke varer længere end 5 år efter overgangsalderen og anbefaler stærkt at undgå hormonbehandling helt hos kvinder over 60 år.1 klinikeren skal nøje afveje de risici og fordele, der er forbundet med syntetiske og sammensatte hormoner, mens man husker det primære mål at forbedre patientens livskvalitet.,
Bioidentical Hormoner
Bioidentical hormoner, såsom østrogener, gestagener, og androgener, er forbindelser, der er udarbejdet i henhold til USP Kapitel <795> Nonsterile Blanding standarder. Disse hormoner kan forværres i forskellige doser og doseringsformer, hvilket skaber mange muligheder for kvinder, der er interesseret i sammensat hormonbehandling (CHT)., Sammensatte formuleringer gennemgår ikke den strenge fremstillings-og renhedsstandardtest, som deres FDA-godkendte kolleger gør; imidlertid, på trods af dette uregulerede miljø, CHT er meget populær blandt patienter, der søger mere “personlig” medicin.
det endokrine samfund har defineret sammensatte bioidentical hormoner som “forbindelser, der har nøjagtig samme kemiske og molekylære struktur som hormoner, der produceres i den menneskelige krop.,”3 FDA hævder, at udtrykket bioidentical hormon er rent en markedsføringsstrategi, da der ikke er noget videnskabeligt grundlag for en implicit fordel eller risikoreduktion for CHT over FDA-godkendt syntetisk hormonbehandling.3
syntetisk hormonbehandling
FDA godkendte diethylstilbestrol i 1941 og konjugerede e .uine estrogens (CEE) i 1942 til behandling af menopausale symptomer.4 fra 1960 ‘ erne steg østrogensalget indtil 1975, da rapporter dukkede op, at østrogenbrug kunne være forbundet med en øget risiko for endometriecancer.,4 Imidlertid blev disse rapporter stort set ignoreret, og østrogenbrug fortsatte. Først i 1996, da postmenopausal østrogen/Progestin Interventions (PEPI) – forsøget blev offentliggjort, begyndte sundhedsudbydere virkelig at forstå de potentielle negative virkninger forbundet med østrogenbehandling. PEPI var et 3-årigt randomiseret, placebo-kontrolleret, dobbelt-blind, multicenter forsøg, der undersøgte den histologiske endometrial virkninger af behandling med syntetiske østrogen versus tre forskellige regimer af syntetisk østrogen plus gestagen.,5
i PEPI-forsøget udviklede signifikant flere personer, der fik østrogen alene, enkel, kompleks eller atypisk endometriehyperplasi versus personer, der fik placebo (tabel 1). Selvom de nøjagtige procentdele ikke blev specificeret, svarede frekvenserne af hyperplasi hos forsøgspersoner, der fik et af de tre østrogen-plus-progestinregimer, til dem, der blev givet placebo.5 sammenfattende administration af østrogen alene i en dosis på 0.,625 mg dagligt førte til en signifikant øget forekomst af endometriehyperplasi, mens kombination af CEE med progestin beskyttede endometrium fra overvækst i betydelig grad.5 på grund af denne dokumenterede endometriecancerrisiko gives progestin altid i kombination med østrogen hos kvinder med en intakt livmoder. Yderligere bekræftelse af denne risiko beskrev en 2007-sagsserie tre kvinder, der brugte CHT indeholdende subterapeutiske doser af progestin og senere udviklede endometriecancer.,6
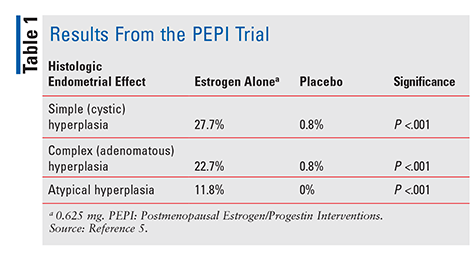
PEPI retssag, sammen med resultaterne på 16,068 postmenopausale kvinder fra Women ‘ s Health Initiative (WHI), der blev offentliggjort i 2002, kaste lys på de alvorlige problemer, der blev rejst i 1970’erne.7 Selv om den PEPI forsøg viste ingen øget risiko for hyperplasi med kombinationen produkt, WHI fundet signifikant øgede risici, der er forbundet med syntetiske hormon brug, såsom hjerte-kar-sygdomme, slagtilfælde, tromboemboliske hændelser, og brystkræft.,7 men Der var en 80% øget risiko for hjerte-kar-sygdom på 1 år efter seponering af en kombination CEE/medroxyprogesteron acetat terapi og 37% øget risiko for iskæmisk slagtilfælde under interventionen fase med kombinationsbehandling. Også brystkræftrisikoen blev signifikant øget (24%) under interventionen. Østrogen-plus-progestin – brug gav nogle fordele, hvor patienter bemærkede en nedsat forekomst af vaginal atrofi, reducerede vasomotoriske symptomer såsom hetetokter og nattesved og en 38% nedsat risiko for tyktarmskræft under behandling med kombinationsterapi.,7 på grund af betydningen af den øgede risiko for brystkræft og tromboemboliske hændelser blev forsøget dog stoppet tidligt.
sammensat hormonbehandling
de ovenfor beskrevne risici banede vejen for CHT-fortalervirksomhed, fordi man troede, at skræddersyning eller tilpasning af CHT til den enkelte patient ville maksimere fordelen og minimere risikoen. Påstande om, at CHT var sikrere og biologisk venligere blev mere fremtrædende, og brugen steg., Pinkerton og Santoro brugte to forskellige undersøgelser-Harris og Rose – til at vurdere patienternes viden om CHT og kvantificere brugen af CHT versus FDA-godkendt hormonbehandling, henholdsvis.8 Resultater af Harris-undersøgelsen viste, at 86% af kvinder i alderen 40 til 65 år var uvidende om, at CHT blev ikke godkendt af FDA, og at ekstrapolere resultaterne af Rose-undersøgelsen foreslået, at der årligt op til 2.5 millioner kvinder ældre end 40 år, kan du bruge CHT.8 Data fra begge undersøgelser viste, at en læge eller apotek havde anbefalet CHT., Disse resultater tyder på, at en mulighed eksisterer for udbyderne til at sikre, at patienterne er informeret om det produkt, de modtager, herunder alle mulige risici, der er forbundet med hormonbehandling, og til sammensætningen apotekere for at sikre, at de leverer en terapeutisk rent produkt, at patienter kan have tillid til.
fordi FDA ikke er ansvarlig for standardisering af sammensatte produkter, falder regulering ofte til statslige bestyrelser for apotek., Disse bestyrelser har typisk ikke ressourcer til at foretage regelmæssige inspektioner af sammensatte apoteker, og FDA griber kun ind, når der fremsættes en klage.9 selvom sammensatte formuleringer ikke er lovligt forpligtet til at bære risikoadvarsler, teoretisk set kan disse produkter udgøre de samme risici som dem, der er nævnt ovenfor for syntetisk hormonbehandling. Til dato har der imidlertid ikke været nogen head-to-head sikkerhedsforsøg med CHT versus syntetiske hormoner.,10
Der er tre typer af østrogener en kvinde kan modtage som en del af en samlet hormonbehandling regime: østron (E1), østradiol (E2), og estriol (E3), som hver har en forskellig grad af styrke (E2 > E1 > E3).9 fordi de kæmper for den samme receptor, fungerer disse østrogener som konkurrencedygtige hæmmere, hvilket resulterer i nedsat effektivitet, hvis de ikke er korrekt afbalanceret.,11 Derfor, tilhængere af CHT, der er udviklet Biest (E2 + E3 i en 20/80 formulering) og Triest (E1 + E2 + E3 i en 10/10/80 formulering) for at maksimere fysiologisk styrke, men der er i øjeblikket ingen beviser til støtte for påstanden om, at disse formuleringer i disse forhold giver nogen sikkerhed fordel sammenlignet med syntetiske hormon terapi.11
Selv om hele CHT har været utilstrækkeligt undersøgt og ureguleret, i oktober 2018, baseret på resultaterne fra GENOPBYGGE retssag, Bijuva blev den første FDA-godkendt bioidentical kombination 17-beta-østradiol-progesteron formulering., REPLENISH, en fase III, randomiseret, dobbeltblind, placebokontrolleret multicenterundersøgelse, undersøgte effektiviteten, endometrial sikkerhed og den samlede sikkerhed ved fire forskellige doser af en enkelt 17-beta østradiol-progesteronkapsel til moderate til svære vasomotoriske symptomer hos postmenopausale kvinder.12 det primære sikkerhedsendepunkt var forekomsten af endometriehyperplasi efter 12 måneder. Efter 12 måneder blev der ikke observeret tilfælde af endometriehyperplasi for nogen af østradiol-progesterondoseringsformuleringerne.,12 efter 12 uger demonstrerede estradiol 1 mg–progesteron 100 mg formuleringen den største statistisk signifikante reduktion i vasomotorisk symptomfrekvens og sværhedsgrad sammenlignet med placebo, samtidig med at de primære sikkerheds-endpoint-standarder blev opretholdt.12 Men som tidligere nævnt har der ikke været nogen forsøg, der sammenligner sikkerheden af syntetiske hormoner versus bioidentical hormonformuleringer,så teoretisk forbliver risikoen.,
konklusion
baseret på REPLENISH-forsøget har præ -, peri-og postmenopausale kvinder nu en standardiseret, reguleret, bioidentical, FDA-godkendt behandling for vasomotoriske symptomer. Fremtidige forsøg er nødvendige for fuldt ud at afgrænse sikkerhedsprofilen for 17-beta østradiol og CHT. Farmaceuter bør anbefale enhver oral hormonformulering i den korteste varighed, der er mulig., Hvis CHT vælges, skal farmaceuter desuden sikre, at deres patienter ved, hvad CHT er, og hvordan det adskiller sig fra syntetiske hormoner, mens de også har en ærlig samtale om fordele og risici ved hormonerstatningsterapi.
1. Martin KA, Manson JE. Tilgang til patienten med menopausale symptomer. J Clin Endocrinol Metab. 2008;93(12):4567-4575.
2. Avis NE, Crawford SL, Greendale G, et al. Varighed af menopausale vasomotoriske symptomer over overgangsalderen. JAMA Intern Med. 2015;175(4):531-539.
3. Santoro N, Braunstein GD, Butts CL, et al., Sammensatte bioidentical hormoner i endokrinologi praksis: en endokrin samfund videnskabelig erklæring. J Clin Endocrinol Metab. 2016;101(4):1318-1343.
4. Stefanick ML. Østrogener og progestiner: baggrund og historie, tendenser i brug, og retningslinjer og regimer, der er godkendt af US Food and Drug Administration. Am J Med. 2005;118(suppl 12B):64-73.
5. Skrive gruppe til PEPI forsøg. Virkninger af hormonerstatningsterapi på endometriehistologi hos postmenopausale kvinder. Den postmenopausale østrogen/Progestin interventioner (PEPI) forsøg. JAMA. 1996;275(5):370-375.
6., Eden JA, Hacker NF, Fortune M. tre tilfælde af endometriecancer forbundet med “bioidentical” hormonbehandling. Med J Aust. 2007;187(4):244-245.
7. Rossou, JE, Anderson gl, Prentice RL, et al. Risici og fordele ved østrogen plus progestin hos raske postmenopausale kvinder: vigtigste resultater fra Womenomen ‘ s Health Initiative randomiseret kontrolleret forsøg. JAMA. 2002;288(3):321-333.
8. Pinkerton JV, Santoro N. sammensat bioidentical hormonbehandling: identificering brug tendenser og huller viden blandt os kvinder. Overgangsalder. 2015;22(9):926-936.
9. Bhavnani BR, Stanczyk FZ., Misforståelse og bekymringer om bioidentical hormoner, der anvendes til custom-sammensat hormonbehandling. J Clin Endocrinol Metab. 2012;97(3):756-759.
10. Bijuva (estradiol og progesteron) indlægsseddel. Boca Raton, FL: TherapeuticsMD, Inc; November 2019.
11. Kuhl H. farmakologi af østrogener og progestogener: indflydelse af forskellige administrationsveje. Climacteric. 2005; 8 (suppl 1): 3-63.
12. Lobo RA, Archer DF, Kagan R, et al. En 17beta-østradiol-progesteron oral kapsel til vasomotoriske symptomer hos postmenopausale kvinder: et randomiseret kontrolleret forsøg. Obstet Gynecol., 2018;132(1):161-170.
Indholdet i denne artikel er kun til orientering. Indholdet er ikke beregnet til at erstatte professionel rådgivning. Afhængighed af alle oplysninger i denne artikel er udelukkende på egen risiko.