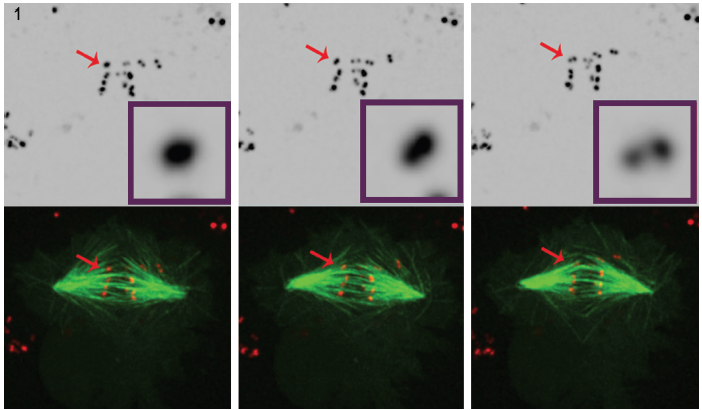
Figur 1. Tre Udvalgte billeder fra en film af POLO-forarmet celler, der klart viser, at over tid, intens centromer/kineto-signal (rød) løser i et par prikker, som viser, at kromosomerne er syntelically knyttet til spindel mikrotubuli (grøn). 4D fluorescensmikroskopi datasæt blev indsamlet hvert 30. sekund med 0.,5 mm z-trin dækker hele cellen lydstyrken ved hjælp af en 100°, 1.4 NA plan-apokromatisk mål ved 25°C med Andor ‘ s Revolution roterende disk konfokal enhed og iXon EMCCD kamera, både drevet af Andor IQ live-celle imaging software.
mitotisk celledeling er afhængig af cellernes evne til korrekt at distribuere søsterchromatider til at danne celler. For pålideligt at udføre funktionen celler bruger interne redigeringsmekanismer til at korrigere unøjagtige kromosom / spindel fiber vedhæftede filer., Parrede kinetochorer er normalt justeret for korrekt at fastgøre spindelfibre og adskille kromatin, imidlertid, fejlagtige og forkert justerede kinetochorer resulterer. Celler indeholder specialiserede redigeringsmekanismer for at forhindre og korrigere disse forkert justerede kinetochore-par, selvom den nøjagtige mekanisme ikke er godt forstået 1,2 ., Det er postuleret af Tatiana Moutinho-Santos ved Universidade do Porto, Portugal er Instituto de Biologia Molekylær e Celular (IBMC), at tilstedeværelsen af POLO-kinase er nødvendige for at fremme kromosom bi-orientering (kaldes amphitelic arrangement) og dermed bevare en ordentlig kineto tilpasning.
for bedre At forstå sin rolle i regulering af kineto udvikling, Dr. Moutinho dos Santos studeret forarmet Drosophila POLO-kinase i levende celler til at underbygge POLO ‘ s involvering i redigering funktioner, der kræves for at opretholde amphitelic kineto arrangement., I dette tilfælde blev syntelisk arrangement (søster kinetochorer knyttet til mikrotubuli, der stammer fra samme spindel) undersøgt. Timelapse analyse af mitose blev udført på Drosophila S2-celler stabilt udtrykke CID-mCherry til visualisering af centromeres, og GFP-en-tubulin til mikrotubuli. Visualisering af kinetochorer er krævende på grund af deres lille størrelse, lavt fluorescerende signal og kort udseende under celledeling. Konfokal fluorescensmikroskopi bruges ofte til at forestille kinetochorer, men selv i dette miljø forbliver visualisering vanskelig., Kinetochorerne er meget små (300 nm) 3, tæt på lysmikroskopets laterale opløsningsevne og overstiger mikroskopets aksiale opløsningsevne. Desuden udgør billeddannende fluorescerende markører i levende celler potentielle fototoksiske og fotoblegende virkninger. Intens laserbelysning kan skabe fototoksicitetsproblemer, især skadelige for levende, opdelte celler.
Andors Revolution confd spinning disk konfokal mikroskopi er ansat til at overvinde Dr. Moutinho dos Santos unikke udfordring forbundet med observation af kinetochores., I dette tilfælde, fire separate faktorer skal samtidig rettet til i tilstrækkelig grad at visualisere den dynamiske cellulære processer:
- Hastighed for overtagelse
- Rumlige og tidsmæssige løse evne
- evnen til at opdage meget lav fluorescens intensitet niveauer
- Forvaltning af tilgængelige fluorescens-signal
Disse temaer, af fysisk, timelige og intensitet beslutning forekomme ofte med fluorescens mikroskopi og er ofte i modstrid med eksperimenter, der involverer observation af cellernes levedygtighed., For eksempel genererer lange kameraeksponeringer og længere perioder med højintensitetsbelysning de fototoksiske virkninger, der beskadiger eller ødelægger levende celler. Samtidig kræver let mærkede mikrostrukturer længere eksponering for at visualisere, men kan påvirkes negativt af fotoblegning. Blanding af problemet er behovet for at kombinere traditionelle tredimensionelle data med tidens. Endelig er det fortsat nødvendigt at skelne signal fra baggrundsstøj og outof – focus dis.
anskaffelseshastighed er af særlig betydning for Dr. Mountinho dos Santos., Kontrol S2-celler udviser en opdelingscyklus på cirka 30 minutter. POLO udtømte S2-celler, der blev brugt i hendes eksperimenter, viste imidlertid en arresteret periode på over otte timer. Optagelse POLO forarmet celledeling kræver samling af mellem 7,200 og 12.000 billede sæt (to fluorochromes optaget hver tredive sekunder i en til fem timer, der er erhvervet på 0,5 micron aksial skridt på op til 20 skridt til aksial kineto-opløsning)., Konventionel fluorescensmikroskopi og laserbelysning tillader hverken de nødvendige blide belysningskrav eller anskaffelseshastigheden at fuldføre denne tidsfølsomme opgave. For eksempel laserrastering i traditionel konfokal mikroskopi kræver længere tidsperioder tid til at indsamle signal fra prøven. Spinning disk konfokale systemer bruges til at overvinde disse traditionelle barrierer og til at afsløre ny indsigt i molekylære kinetochore redigeringsteknikker.,
sammenlignet med konventionelle wididefield fluorescens systemer, den rumlige opløsning af en roterende disk konfokal er overlegen i både laterale (and og y) og aksiale ()) dimensioner. Gennem den konstante scanning af pinhole-arrayet kan prøver ses i realtid ved høj kontrast, hvilket giver klare billeder ved diffraktionsgrænserne for mikroskopets optik. Dette muliggør 3D-visualisering og forståelse af den dynamiske kinetochore-opførsel i forhold til spindelens mikrotubuli., Kineto og centromer lateral opløsning på 300 nm og spindel fiber beslutning af 300-500 nm blev rapporteret, og som er beskrevet i Figur A.
Intensitet Opløsning
at Visualisere fluorescensmærkede kinetokorer, der er forbundet med hver centromer steder yderligere krav til erhvervelse system. De undersøgte centromerer og kinetochorer er primært kun synlige under celledeling interfase. Når cellerne passerer gennem prophase, har centromererne allerede løst sig i Drosophilas typiske tolv kromosompar., Styring af tilgængelige lys budget under langvarig erhvervelse nødvendiggør blid belysning og høj opløsning stand ved at dreje disk teknikker. Åbningerne i den roterende diskenhed giver disse fordele. Fordi lys kun ophidser fluoroforer, når en blænde er til stede, minimeres fototoksiske virkninger. Mens counterintuitive, et reduceret lys budget indikerer ikke svage, svære at opdage objekter. Intensitetsopløsningen øges gennem den roterende disks udelukkelse af ude af fokussignal og efterfølgende signalforstærkning af en EMCCD-kameraarkitektur., Dette skaber den nye mulighed for at generere højere kontrastbilleder, der afslører udviklingen og justeringen af punkterede objekter som kinetochores.
konklusioner
brugen af spinning disk teknologi i Dr. Mountinho dos Santos live cell ansøgning førte til en vigtig observation. I fravær af POLOKINASEN blev Drosophila-celler vist at mangle de korrigerende mekanismer, der er nødvendige for at opretholde amphitelisk kromosomarrangement., Tilstedeværelsen af POLO viste sig at give det rette miljø for korrekt centromere arkitektur, samtidig med at man sikrer korrekt kromosom bi-orientering. Kulturperler Drosophila celler undergår mitose i mangel af POLO-kinase kromosomer lægger til tentrådene med syntelic retning, dvs, med søster kinetokorer knyttet til mikrotubuli, der kommer fra en enkelt spindel pole.
denne konklusion blev trukket ved omhyggelig analyse af 4D-fluorescensmikroskopi i celler, der udtrykker fluorescerende mærket centromere / kinetochore markør og mikrotubuli. (Figur 1).