langt svar. For det første skal der sondres mellem polariteten af en binding og polariteten af et molekyle (eller forbindelse).
Bindingspolaritet henviser til en adskillelse af elektrisk ladning, der er resultatet af en forskel i elektronegativitet mellem de to atomer eller grupper, der binder sammen.,
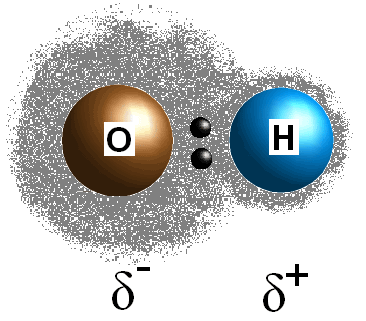
Denne forskel i elektronegativiteten værdier mellem de to atomer forårsager bond elektroner deles ligeligt, således at der skabes en positiv ladning (#delta^+#) på mindre elektronegative atom og en delvis negativ ladning (#delta^(-)#) på mere elektronegative atom. Polariteten af en binding kan bestemmes ved udelukkende at anvende elektronegativitetsværdierne for de to bestanddele atomer.
Hvis bindingen mellem de to atomer i ikke polær, dvs.forskellen i elektronegativitet mellem de to atomer er mindre end 0.,5, så vil dit molekyle være ikke-polært. Hvis bindingen faktisk er polær, kan du fortsætte med at prøve at bestemme molekylets polaritet.
et molekyls geometri er en vigtig faktor til bestemmelse af polariteten af et molekyle. Disse førnævnte delvise ladninger giver anledning til et bindingsdipolmoment, #mu#.
Hvis orienteringerne af disse bond dipol-øjeblikke annullerer hinanden, siges molekylet at være ikke-polært. Hvis de dog ikke gør det, har du at gøre med et polært molekyle.,
Nogle eksempler på, hvor bond dipol øjeblikke annullere hinanden, hvilket resulterer i en ikke-polært molekyle:
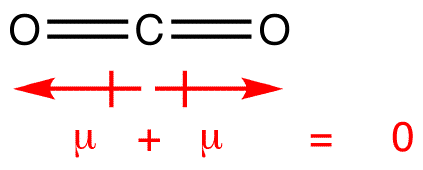
Dipol øjeblikke er tegnet med pil, der peger på mere elektronegative atom-og plus-side på mindre elektronegative atom. Bemærk, at for #CO_2#, som har to polære bindinger, er det samlede dipolmoment nul, da disse to pile annullerer hinanden. Dette resulterer i et ikke-polært molekyle., Det samme kan siges for #bf_3#:
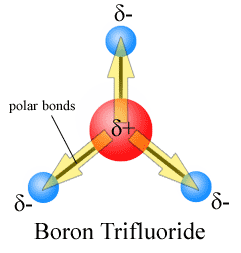
de tre dipolmomenter annullerer hinanden som et resultat af bindingernes symmetriske arrangement (se mere om vektortilsætning).
En assymetrical arrangement af den delvise afgifter resultater i et polært molekyle, som du kan se for vand:
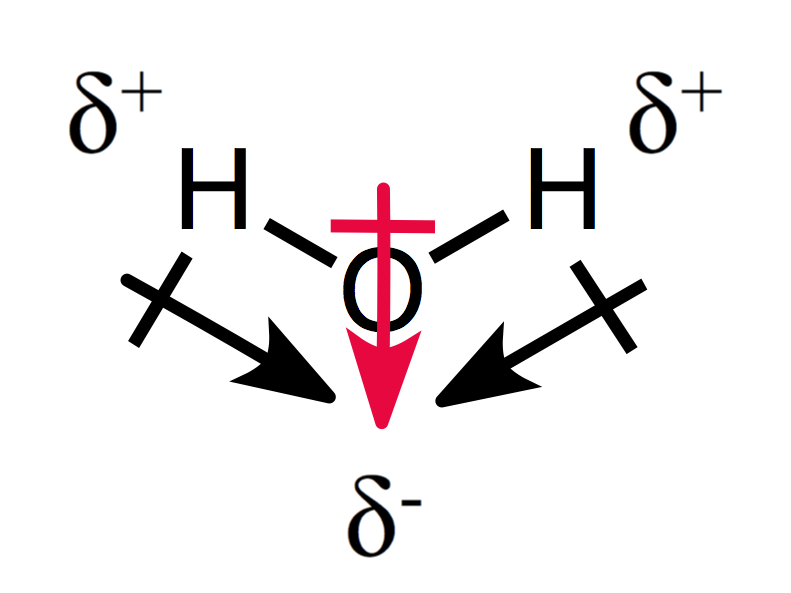
De to dipol øjeblikke tilføj til hinanden for at skabe et samlet dipol øjeblik, og for således et polært molekyle.,
som en konklusion, for at forudsige et molekyls polaritet, skal du være bekendt med Le .is-strukturer, elektronegativitet, VSEPR-teori og bindingspolaritet.