læringsmål
Ved udgangen af dette afsnit vil du være i stand til:
- beskrive, hvordan elektroner blev opdaget.
- Forklar Millikan – oliedråbeeksperimentet.
- beskriv Rutherfords guldfolieeksperiment.
- beskriv Rutherfords planetariske model af atomet.
ligesom atomer er en understruktur af stof, elektroner og kerner er understrukturer af atomet., Eksperimenterne, der blev brugt til at opdage elektroner og kerner, afslører nogle af de grundlæggende egenskaber ved atomer og kan let forstås ved hjælp af ideer som elektrostatisk og magnetisk kraft, der allerede er dækket i tidligere kapitler.
ladninger og elektromagnetiske kræfter
i tidligere diskussioner har vi bemærket, at positiv ladning er forbundet med kerner og negativ ladning med elektroner. Vi har også dækket mange aspekter af de elektriske og magnetiske kræfter, der påvirker ladninger., Vi vil nu undersøge opdagelsen af elektronen og kernen som understrukturer af atomet og undersøge deres bidrag til atomernes egenskaber.
elektronen

Figur 1. Et gasudladningsrør lyser, når der påføres en højspænding. Elektroner, der udsendes fra katoden, accelereres mod anoden; de ophidser atomer og molekyler i gassen, som lyser som svar., Når de blev kaldt Geissler-rør og senere Crookes-rør, er de nu kendt som katodestrålerør (CRT ‘er) og findes i ældre tv’ er, computerskærme og røntgenmaskiner. Når et magnetfelt påføres, bøjer strålen i den retning, der forventes for negativ ladning. (kredit: Paul Do .ney, Flickr)
gasudladningsrør, såsom det, der er vist i Figur 1, består af et evakueret glasrør indeholdende to metalelektroder og en sjælden gas. Når en højspænding påføres elektroderne, lyser gassen. Disse rør var forløberne til nutidens neonlys., De blev først undersøgt alvorligt af Heinrich Geissler, en tysk opfinder og glassblower, der starter i 1860’erne. Den engelske forsker William Crookes, blandt andre, fortsatte med at studere, hvad der i nogen tid blev kaldt Crookes rør, hvori elektroner, der frigøres fra atomer og molekyler i den tynde gas inde i røret, og er accelereret fra katode (negativ) til anoden (positiv) af det store potentiale., Disse “katodestråler” kolliderer med gasatomer og molekyler og ophidser dem, hvilket resulterer i emission af elektromagnetisk (EM) stråling, der gør elektronernes vej synlig som en stråle, der spreder sig og falmer, når den bevæger sig væk fra katoden.
gasudladningsrør i dag kaldes oftest katodestrålerør, fordi strålerne stammer fra katoden. Crookes viste, at elektronerne bærer momentum (de kan få et lille skovlhjul til at rotere)., Han fandt også, at deres normalt lige vej er bøjet af en magnet i den retning, der forventes for en negativ ladning, der bevæger sig væk fra katoden. Disse var de første direkte indikationer på elektroner og deres ladning.

Figur 2. J. J. Thomson (kredit: www.firstworldwar.com, via Commonsikimedia Commons)
den engelske fysiker J. J. Thomson (1856-1940) forbedrede og udvidede omfanget af eksperimenter med gasudladningsrør. (Se figur 2 og figur 3.,) Han verificerede den negative ladning af katodestrålerne med både magnetiske og elektriske felter. Derudover indsamlede han strålerne i en metalkop og fandt et overskud af negativ ladning. Thomson var også i stand til at måle forholdet ladningen af en elektron til dets masse, \frac{q_e}{m_e}\\—et vigtigt skridt for at finde de faktiske værdier af både kvantitative lempelser og mig. Figur 4 viser et katodestrålerør, der frembringer en smal stråle af elektroner, der passerer gennem ladeplader forbundet til en højspændingsstrømforsyning., Et elektrisk felt E produceres mellem ladepladerne, og katodestrålerøret placeres mellem polerne på en magnet, så det elektriske felt E er vinkelret på magnetfeltet B af magneten. Disse felter, der er vinkelret på hinanden, producerer modsatte kræfter på elektronerne. Som diskuteret for massespektrometre i flere anvendelser af magnetisme, hvis netkraften på grund af felterne forsvinder, er hastigheden af den ladede partikel v=\frac{E}{b}\\., På denne måde bestemte Thomson elektronernes hastighed og flyttede derefter strålen op og ned ved at justere det elektriske felt.

Figur 3. Diagram over Thomsons CRT. (credit: Kurzon, Wikimedia Commons)

Figur 4. Denne skematiske viser elektronstrålen i en CRT, der passerer gennem krydsede elektriske og magnetiske felter og får fosfor til at gløde, når den rammer enden af røret.
Indsamling vilkår, vi har \frac{q_e}{m_e}=\frac{a}{E}\\.,
Hvad er så vigtigt om \frac{\_e}{m_e}\\, forholdet mellem elektronens ladning og dens masse? Den opnåede værdi er
\displaystyle\frac{q_e}{m_e}=-1.76\times10^{11}\text{ C/kg (elektron)}\\
Dette er et stort antal, som Thomson realiseres, og det betyder, at elektronen har en meget lille masse. Det var kendt fra galvanisering, at omkring 108 C / kg er nødvendig for at plade et materiale, en faktor på omkring 1000 mindre end ladningen pr kilogram elektroner., Thomson gik på at gøre det samme eksperiment for positivt ladede brintioner (nu kendt for at være nøgne protoner) og fandt en afgift per kilo om 1000 gange mindre end for elektroner, hvilket indebærer, at proton er omkring 1000 gange tungere end elektronen. Vi ved i dag, mere præcist, at
\displaystyle\frac{q_p}{m_p}=9.58\times10^{7}\text{ C/kg (proton)}\\,
hvor qp er ladningen af en proton og mp er dens masse. Dette forhold (til fire signifikante tal) er 1836 gange mindre ladning pr., Da ladningerne af elektroner og protoner er ens i størrelse, indebærer dette mp = 1836me.
Thomson udførte en række eksperimenter ved anvendelse af forskellige gasser i udløbsrør og ved anvendelse af andre metoder, såsom den fotoelektriske virkning, til frigørelse af elektroner fra atomer. Han har altid fundet de samme egenskaber for elektronen, der beviser, at det er en uafhængig partikel. For sit arbejde, de vigtige stykker, som han begyndte at udgive i 1897, blev Thomson tildelt Nobelprisen i fysik i 1906., I eftertid er det svært at forstå, hvor forbløffende det var at finde ud af, at atomet har en understruktur. Thomson selv sagde: “det var først, da jeg var overbevist om, at eksperimentet ikke efterlod nogen flugt fra det, at jeg offentliggjorde min tro på eksistensen af organer, der er mindre end atomer.”
Thomson forsøgte at måle ladningen af individuelle elektroner, men hans metode kunne kun bestemme dens ladning i den forventede størrelsesorden.
siden Faradays eksperimenter med galvanisering i 1830 ‘ erne havde det været kendt, at omkring 100.000 C pr., Ved at dividere dette med antallet af ioner pr.mol (Det vil sige ved Avogadros nummer), som var omtrent kendt, blev ladningen pr.

Figur 5. Robert Millikan (credit: Ukendt Forfatter, via Wikimedia Commons)
En Amerikansk fysiker, Robert Millikan (1868-1953) (se Figur 5), har besluttet at forbedre Thomson ‘ s eksperiment for at måle qe og blev til sidst tvunget til at prøve en anden tilgang, som nu er et klassisk eksperiment udført af studerende., Millikan oliedråbe eksperimentet er vist i figur 6.
i Millikan-oliedråbeeksperimentet sprøjtes fine dråber olie fra en forstøver. Nogle af disse oplades af processen og kan derefter suspenderes mellem metalplader ved en spænding mellem pladerne. I denne situation, vægten af drop er balanceret af den elektriske kraft:
m dropg = qe E

Figur 6., Millikan – oliedråbeeksperimentet producerede den første nøjagtige direkte måling af ladningen på elektroner, en af de mest grundlæggende konstanter i naturen. Fine dråber olie bliver opladet, når de sprøjtes. Deres bevægelse observeres mellem metalplader med et potentiale anvendt til at modsætte sig tyngdekraften. Balancen mellem gravitations-og elektriske kræfter tillader beregning af ladningen på en dråbe. Ladningen viser sig at være kvantiseret i enheder på -1,6 10-1 10-19 C, hvorved man direkte bestemmer ladningen af overskydende og manglende elektroner på oliedråberne.,
det elektriske felt produceres af den påførte spænding, derfor E=\frac{V}{d}\\, og V justeres for bare at afbalancere dråbens vægt. Dråberne kan ses som reflekterede lyspunkter ved hjælp af et mikroskop, men de er for små til direkte at måle deres størrelse og masse. Dråbens masse bestemmes ved at observere, hvor hurtigt det falder, når spændingen er slukket. Da luftmodstand er meget signifikant for disse submikroskopiske dråber, falder de mere massive dråber hurtigere end de mindre massive, og sofistikerede sedimentationsberegninger kan afsløre deres masse., Olie bruges snarere end vand, fordi det ikke let fordamper, og så masse er næsten konstant. Når massen af drop er kendt, ladningen af en elektron er givet ved omordning af den foregående ligning:
\displaystyle{q}=\frac{m_{\text{drop}}g}{E}=\frac{m_{\text{drop}}gd}{V}\\,
hvor d er adskillelse af plader og V er den spænding, der holder drop ubevægelig. (Det samme fald kan observeres i flere timer for at se, at det virkelig er ubevægeligt.,) I 1913 Millikan havde målt ladningen af en elektron qe til en nøjagtighed på 1%, og han forbedret med en faktor 10 inden for et par år til en værdi af -1.60 × 10-19 C. Han bemærkede også, at alle anklager blev multipla af den grundlæggende electron betaling, og at pludselige ændringer kan forekomme, hvor elektronerne blev tilføjet eller fjernet fra drops. Til denne meget grundlæggende direkte måling afee og for hans studier af den fotoelektriske effekt blev Millikan tildelt Nobelprisen i fysik i 1923.,
med ladningen af den kendte elektron og det kendte ladnings-til-masseforhold kan elektronens masse beregnes. Det er
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
at Erstatte kendte værdier udbytter
\displaystyle{m}_e=\frac{-1.60\times10^{-19}\text{ C}}{-1.76\times10^{11}\text{ C/kg}}\\
eller mig = 9.11 × 10-31 kg (elektron-masse), hvor den runde-off fejl er blevet rettet., Elektronens masse er blevet verificeret i mange efterfølgende eksperimenter og er nu kendt med en nøjagtighed på bedre end en del i en million. Det er en utrolig lille masse og forbliver den mindste kendte masse af enhver partikel, der har masse. (Nogle partikler, såsom fotoner, er masseløse og kan ikke bringes til hvile, men rejser med lysets hastighed.) En lignende beregning giver masserne af andre partikler, herunder protonen. Til tre cifre, massen af en proton er nu kendt for at være mp = 1.67 × 10-27 kg (proton masse), som er næsten identisk med massen af et brintatom., Hvad Thomson og Millikan havde gjort var at bevise eksistensen af en understruktur af atomer, elektroner, og yderligere at vise, at det havde kun en lille brøkdel af massen af et atom. Kernen i et atom indeholder det meste af dets masse, og kernens natur var fuldstændig uventet.
et andet vigtigt kendetegn ved kvantemekanik begyndte også at dukke op. Alle elektroner er identiske med hinanden. Ladningen og massen af elektroner er ikke gennemsnitsværdier; snarere er de unikke værdier, som alle elektroner har., Dette gælder for andre grundlæggende enheder på det submikroskopiske niveau. Alle protoner er identiske med hinanden, og så videre.
kernen
Her undersøger vi det første direkte bevis for kernens størrelse og masse. I senere kapitler vil vi undersøge mange andre aspekter af kernefysik, men de grundlæggende oplysninger om kernestørrelse og masse er så vigtige for at forstå atomet, at vi betragter det her.
nuklear radioaktivitet blev opdaget i 1896, og det var snart genstand for intens undersøgelse af en række af de bedste forskere i verden., Blandt dem var ne .ealealander Lord Ernest Rutherford, der lavede adskillige grundlæggende opdagelser og tjente titlen “kernefysikens far.”Født i Nelson, Rutherford gjorde hans postgraduate studier på Cavendish Laboratories i England, før han tiltrådte en stilling ved McGill University i Canada, hvor han gjorde det arbejde, der tjente ham en Nobelpris i kemi i 1908. Inden for atomisk og nuklear fysik er der meget overlapning mellem Kemi og fysik, hvor fysik giver de grundlæggende aktiveringsteorier., Han vendte tilbage til England i senere år og havde seks fremtidige Nobelprisvindere som studerende. Rutherford brugte nuklear stråling til direkte at undersøge atomkernens størrelse og masse. Eksperimentet han udtænkt er vist i Figur 7. En radioaktiv kilde, der udsender alfastråling, blev anbragt i en blybeholder med et hul i den ene side for at producere en stråle af alfapartikler, som er en type ioniserende stråling, der udstødes af kernerne i en radioaktiv kilde., En tynd guldfolie blev anbragt i bjælken, og spredningen af alfapartiklerne blev observeret af den glød, de forårsagede, da de ramte en fosforskærm.

Figur 5. Rutherfords eksperiment gav direkte bevis for kernens størrelse og masse ved at sprede alfapartikler fra en tynd guldfolie. 5mev udsendes fra en radioaktiv kilde (som er en lille metalbeholder, hvori en bestemt mængde af et radioaktivt materiale er forseglet), kollimeres ind i en stråle og falder på folien., Antallet af partikler, der trænger ind i folien eller spredes til forskellige vinkler, indikerer, at guldkerner er meget små og indeholder næsten hele guldatomets masse. Dette er især indikeret af alfapartiklerne, der spreder sig til meget store vinkler, ligesom en fodbold, der hopper ud af en målmands hoved.,
alfapartikler var kendt for at være de dobbeltladede positive kerner af heliumatomer, der havde kinetiske energier i størrelsesordenen 5 MeV, når de udsendes i nukleart henfald, hvilket er desintegrationen af kernen i et ustabilt nuklid ved spontan emission af ladede partikler. Disse partikler interagerer mest med Stof via Coulomb-kraften, og den måde, hvorpå de spredes fra kerner, kan afsløre kernestørrelse og masse. Dette er analogt med at observere, hvordan en bo .lingkugle er spredt af et objekt, du ikke kan se direkte., Fordi alfa-partikel ‘ s energi er så stor, sammenlignet med den typiske energi i forbindelse med atomer (MeV versus eV), du ville forvente af alfa-partikler til blot at gå ned gennem en tynd folie meget gerne en supersonisk bowling bolden ville gå ned gennem et par dusin rækker af bowling pins. Thomson havde forestillet sig atom at være en lille kugle, hvor lige store mængder af positive og negative ladning blev fordelt jævnt. Hændelsen massive alfapartikler ville lide kun små afbøjninger i en sådan model., I stedet fandt Rutherford og hans samarbejdspartnere, at alfapartikler lejlighedsvis blev spredt i store vinkler, nogle endda tilbage i den retning, hvorfra de kom! Detaljeret analyse ved hjælp af bevarelse af momentum og energi—især af det lille antal, der kom lige tilbage—indebar, at guldkerner er meget små sammenlignet med størrelsen af et guldatom, indeholder næsten hele atomets masse og er tæt bundet. Da guldkernen er flere gange mere massiv end alfapartiklen, ville en head-on kollision sprede alfapartiklen lige tilbage mod kilden., Desuden, jo mindre kernen, jo færre alfapartikler, der ville ramme et hoved på.
selvom resultaterne af eksperimentet blev offentliggjort af hans kolleger i 1909, tog det Rutherford to år at overbevise sig om deres betydning. Som Thomson før ham var Rutherford tilbageholdende med at acceptere sådanne radikale resultater. Naturen i lille skala er så ulig vores klassiske verden, at selv de, der er i spidsen for opdagelsen, undertiden bliver overrasket. Rutherford skrev senere: “det var næsten lige så utroligt som om du fyrede en 15-tommer skal på et stykke tissuepapir, og det kom tilbage og ramte dig., Ved overvejelse indså jeg, at denne spredning baglæns . . . . . . den største del af atomets masse var koncentreret i en lille kerne.”
i 1911 offentliggjorde Rutherford sin analyse sammen med en foreslået model af atomet. Størrelsen af kernen blev bestemt til at være omkring 10-15 m, eller 100.000 gange mindre end atomet. Dette indebærer en enorm tæthed i størrelsesordenen 1015 g / cm3, meget i modsætning til ethvert makroskopisk stof. Også underforstået er eksistensen af tidligere ukendte nukleare kræfter til at modvirke de enorme frastødende Coulomb kræfter blandt de positive ladninger i kernen., Kæmpe kræfter ville også være i overensstemmelse med de store energier, der udsendes i nuklear stråling.

Figur 8. Et udvidet billede af atomerne i guldfolien i Rutherfords eksperiment. 10-10 m i diameter), mens prikkerne repræsenterer kernerne (omkring 10-15 m i diameter). For at være synlig er prikkerne meget større end skalaen. De fleste alfapartikler gå ned igennem, men er relativt upåvirket på grund af deres høje energi og elektronens lille masse., Nogle går dog lige mod en kerne og er spredt lige tilbage. En detaljeret analyse giver størrelsen og massen af kernen.
den lille størrelse af kernen indebærer også, at atomet for det meste er tomt indeni. Faktisk gik de fleste alphas i Rutherfords eksperiment lige gennem guldfolien med meget lidt spredning, da elektroner har så små masser, og da atomet for det meste var tomt uden noget for Alfa at ramme., Der var allerede antydninger af dette på det tidspunkt Rutherford udførte sine eksperimenter, da energiske elektroner var blevet observeret at trænge igennem tynde folier lettere end forventet. Figur 8 viser en skematisk af atomerne i en tynd folie med cirkler, der repræsenterer størrelsen af atomerne (ca. 10-10 m) og prikker, der repræsenterer kernerne. (Prikkerne skal ikke skaleres—hvis de var, ville du have brug for et mikroskop for at se dem.) De fleste alfapartikler savner de små kerner og er kun lidt spredt af elektroner., Lejlighedsvis (ca.en gang i 8000 gange i Rutherfords eksperiment) rammer en alfa en kerne head-on og spredes lige bagud.

Figur 9. Rutherford ‘ s planetariske model af atomet inkorporerer de særlige kendetegn ved kernen, elektroner, og størrelsen af atomet. Denne model var den første til at genkende strukturen af atomer, hvor lavmasseelektroner kredser om en meget lille, massiv kerne i kredsløb, der er meget større end kernen. Atomet er for det meste tomt og er analogt med vores planetariske system.,
baseret på størrelsen og massen af kernen afsløret af hans eksperiment, såvel som massen af elektroner, foreslog Rutherford atomets planetariske model. Den planetariske model af atomet billeder lav masse elektroner kredser om en stor masse kerne. Størrelsen af elektronbanerne er store sammenlignet med størrelsen af kernen, med for det meste vakuum inde i atomet. Dette billede er analogt med, hvordan lavmasseplaneter i vores solsystem kredser om stormassesolen i store afstande sammenlignet med solens størrelse., I atomet er den attraktive Coulomb-kraft analog med gravitation i planetsystemet. (Se Figur 9.) Bemærk, at der er behov for en model eller et mentalt billede for at forklare eksperimentelle resultater, da atomet er for lille til at blive observeret direkte med synligt lys.Rutherfords planetariske model af atomet var afgørende for at forstå atomernes egenskaber og deres interaktioner og energier, som vi skal se i de næste par afsnit. Det var også en indikation af, hvor forskellig natur er fra den velkendte klassiske verden på den lille kvantemekaniske skala., Opdagelsen af en underkonstruktion at alt stof i form af atomer og molekyler, blev nu taget et skridt videre til at afsløre en underkonstruktion af atomer, der var enklere end 92 elementer så kendt. Vi har fortsat med at søge efter dybere understrukturer, såsom dem inde i kernen, med en vis succes. I senere kapitler vil vi følge denne søgen i diskussionen af kvarker og andre elementære partikler, og vi vil se på den retning, søgningen ser ud til at være på vej.,
PhET-udforskninger: Rutherford-spredning
hvordan fandt Rutherford ud af atomets struktur uden at kunne se det? Simuler det berømte eksperiment, hvor han modbeviste atomets Blommepudding-model ved at observere alfapartikler, der springer af atomer og bestemmer, at de skal have en lille kerne.
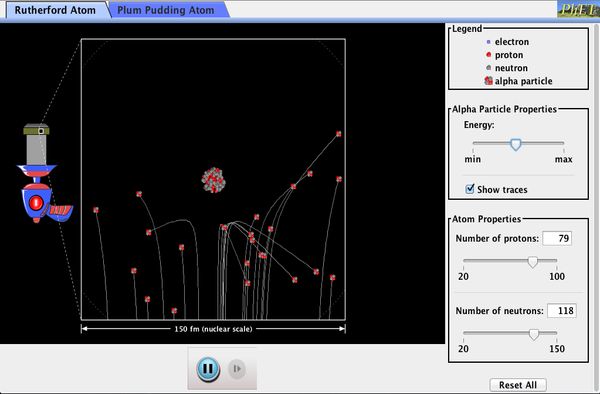
Klik for at downloade simulation. Kør ved hjælp af Java.,
– Afsnittet Resumé
Problemer & Øvelser
- Rutherford fandt størrelsen af kernen til at være omkring 10-15 m. Dette betød en enorm tæthed. Hvad ville denne tæthed være for guld?
- i Millikans oliedråbeeksperiment ser man på en lille oliedråbe, der holdes ubevægelig mellem to plader. Tag spændingen mellem pladerne til at være 2033 V, og pladeseparationen til at være 2,00 cm. Olie drop (tæthed 0.81 g/cm3) har en diameter på 4,0 × 10-6 m. Finde på drop, i form af elektron-enheder.,
- (a) en håbefuld fysiker ønsker at bygge en skalamodel af et hydrogenatom til sit science fair-projekt. Hvis atomet er 1,00 m i diameter, hvor stor skal hun forsøge at lave kernen? (b) hvor let vil det være at gøre?