membranproteiner
mens lipider er de grundlæggende strukturelle elementer i membraner, er proteiner ansvarlige for at udføre specifikke membranfunktioner. 50% lipid og 50% protein efter vægt, idet kulhydratdelene af glycolipider og glycoproteiner udgør 5 til 10% af membranmassen. Da proteiner er meget større end lipider, svarer denne procentdel til ca.et proteinmolekyle pr., I 1972 foreslog Jonathan Singer og Garth Nicolson den flydende mosaikmodel af membranstruktur, som nu generelt accepteres som det grundlæggende paradigme for organisationen af alle biologiske membraner. I denne model ses membraner som todimensionale væsker, hvori proteiner indsættes i lipid-dobbeltlag (figur 12.3).

figur 12.3
væskemosaikmodel af plasmamembranen., Integrerede membranproteiner indsættes i lipid-dobbeltlaget, hvorimod perifere proteiner indirekte er bundet til membranen ved protein-proteininteraktioner. De fleste integrerede membranproteiner er transmembrane (mere…)
sanger og Nicolson skelnet mellem to klasser af membranassocierede proteiner, som de kaldte perifere og integrerede membranproteiner., Perifere membranproteiner blev operationelt defineret som proteiner, der adskiller sig fra membranen efter behandlinger med polære reagenser, såsom opløsninger med ekstrem pH eller høj saltkoncentration, der ikke forstyrrer phospholipid-dobbeltlaget. Når dissocieret fra membranen, er perifere membranproteiner opløselige i vandige buffere. Disse proteiner indsættes ikke i det hydrofobe indre af lipid-dobbeltlaget. I stedet er de indirekte forbundet med membraner gennem protein-proteininteraktioner., Disse interaktioner involverer ofte ionbindinger, som forstyrres af ekstrem pH eller højt salt.
i modsætning til de perifere membranproteiner kan integrerede membranproteiner kun frigives ved behandlinger, der forstyrrer phospholipid-dobbeltlaget. Dele af disse integrerede membranproteiner indsættes i lipid-dobbeltlaget, så de kun kan dissocieres af reagenser, der forstyrrer hydrofobe interaktioner., De mest almindeligt anvendte reagenser til opløsning af integrerede membranproteiner er vaskemidler, som er små amfipatiske molekyler indeholdende både hydrofobe og hydrofile grupper (figur 12.4). De hydrofobe dele af vaskemidler fortrænger membranlipider og binder til de hydrofobe dele af integrerede membranproteiner. Fordi den anden ende af detergentmolekylet er hydrofil, er detergentproteinkomplekserne opløselige i vandige opløsninger.

figur 12.4
opløsning af integrerede membranproteiner ved vaskemidler., Detergenter (f Oct octylglucosid) er amfipatiske molekyler, der indeholder hydrofile hovedgrupper og hydrofobe haler. De hydrofobe haler binder til de hydrofobe områder af integreret membran (mere …)
mange integrerede proteiner er transmembrane proteiner, der spænder over lipid-dobbeltlaget med dele udsat på begge sider af membranen. Disse proteiner kan visualiseres i elektronmikrografer af plasmamembraner fremstillet ved frysefrakturteknikken (se figur 1.35). I disse prøver opdeles membranen og adskilles i sine to foldere., Transmembrane proteiner er derefter synlige som partikler på membranens indre flader (figur 12.5).

Figur 12.5
Frys-fraktur electron micrograph af humane røde blodlegemer membraner. Partiklerne i membranen er transmembrane proteiner. (Harold H. Ed .ards/Visuals Unlimited.,)
en membran, der strækker dele af transmembrane proteiner er normalt α-helices af 20 til 25 hydrofobe aminosyrer, der er indsat i membranen af endoplasmatisk reticulum under en syntese af polypeptid kæde (se figur 9.11, 9.12 og 9.13). Disse proteiner transporteres derefter i membranvesikler fra det endoplasmatiske retikulum til Golgi-apparatet og derfra til plasmamembranen., Kulhydratgrupper tilsættes til polypeptidkæderne i både det endoplasmatiske retikulum og Golgi-apparat, så de fleste transmembrane proteiner i plasmamembranen er glycoproteiner med deres oligosaccharider udsat for overfladen af cellen.
undersøgelser af røde blodlegemer har givet gode eksempler på både perifere og integrerede proteiner forbundet med plasmamembranen. Membranerne af humane erythrocytter indeholder omkring et dusin store proteiner, som oprindeligt blev identificeret ved gelelektroforese af membranpræparater., De fleste af disse er perifere membranproteiner, der er identificeret som komponenter i det kortikale cytoskelet, der ligger til grund for plasmamembranen og bestemmer celleform (se Kapitel 11). For eksempel er det mest rigelige perifere membranprotein af røde blodlegemer spectrin, som er det største cytoskeletale protein af erythrocytter. Andre perifere membranproteiner af røde blodlegemer inkluderer actin, ankyrin og bånd 4.1., Ankyrin fungerer som den vigtigste forbindelse mellem plasmamembranen og cytoskelettet ved at binde til både spectrin og det integrerede membranproteinbånd 3 (se figur 11.11). En yderligere forbindelse mellem membranen og cytoskelettet er tilvejebragt af bånd 4.1, som binder til forbindelserne mellem spectrin og actin såvel som glycophorin (det andet store integrerede membranprotein af erythrocytter).
de to vigtigste integrerede membranproteiner fra røde blodlegemer, glycophorin og band 3, giver godt studerede eksempler på transmembranproteinstruktur (figur 12.6)., Glycophorin er et lille glycoprotein på 131 aminosyrer, med en molekylvægt på omkring 30.000, hvoraf halvdelen er protein og halv kulhydrat. Glycophorin krydser membranen med en enkelt membran-spænder α-Heli.af 23 aminosyrer, med dens glycosylerede amino-terminale del eksponeret på celleoverfladen. Selvom glycophorin var et af de første transmembranproteiner, der blev karakteriseret, forbliver dets præcise funktion ukendt. I modsætning hertil forstås funktionen af det andet store transmembranprotein fra røde blodlegemer godt., Dette protein, oprindeligt kendt som band 3, er aniontransportøren ansvarlig for passage af bicarbonat (HCO3-) og chlorid (Cl-) ioner over den røde blodcellemembran. Bånd 3-polypeptidkæden er 929 aminosyrer og menes at have 14 membran-spændende A-spiralformede regioner. Inden i membranen danner dimerer af bånd 3 kugleformede strukturer indeholdende indre kanaler, gennem hvilke ioner er i stand til at rejse over lipid-dobbeltlaget.
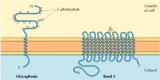
figur 12.6
Integrale membranproteiner af røde blodlegemer., Glycophorin (131 aminosyrer) indeholder en enkelt transmembran a-Heli.. Det er stærkt glyocosyleret, med oligosaccharider bundet til 16 steder på den ekstracellulære del af polypeptidkæden. (mere…)
På grund af deres amfipatiske karakter har transmembranproteiner vist sig vanskelige at krystallisere, som krævet til tredimensionel strukturel analyse ved røntgendiffraktion., Det første transmembranprotein, der blev analyseret ved røntgenkrystallografi, var det fotosyntetiske reaktionscenter for bakterien Rhodopseudomonas viridis, hvis struktur blev rapporteret i 1985 (figur 12.7). Reaktionscentret indeholder tre transmembrane proteiner, betegnet L, M og H (lys, medium og tung) i henhold til deres tilsyneladende størrelser angivet ved gelelektroforese. L og M underenheder hver har fem membran-spænder α helices. H-underenheden har kun en enkelt transmembran a-Heli., med hovedparten af polypeptidkæden på den cytosoliske side af membranen., Den fjerde underenhed af reaktionscentret er et cytokrom, som er et perifert membranprotein bundet til komplekset ved protein-proteininteraktioner.

figur 12.7
et bakterielt fotosyntetisk reaktionscenter. Reaktionscentret består af tre transmembrane proteiner, betegnet L (Rød), M (gul) og H (grøn). L – og M-underenhederne har hver fem transmembrane a-helices, mens H-underenheden kun har (mere…)
selvom de fleste transmembrane proteiner spænder over membranen med A-spiralformede regioner, er dette ikke altid tilfældet., En velkarakteriseret undtagelse er tilvejebragt af porinerne-en klasse af proteiner, der danner kanaler i de ydre membraner af nogle bakterier. Mange bakterier, herunder E. coli, har et dobbelt membransystem, hvor plasmamembranen (eller den indre membran) er omgivet af cellevæggen og en tydelig ydre membran (figur 12.8). I modsætning til plasmamembranen er den ydre membran meget permeabel for ioner og små polære molekyler (i tilfælde af E. coli, med molekylvægte op til 600). Denne permeabilitet skyldes porinerne, der danner åbne vandige kanaler gennem lipid-dobbeltlaget., Som diskuteret i kapitel 10 findes proteiner relateret til bakterieporinerne også i de ydre membraner af mitokondrier og chloroplaster.
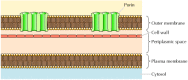
figur 12.8
bakterielle ydre membraner. Plasmamembranen hos nogle bakterier er omgivet af en cellevæg og en tydelig ydre membran. Den ydre membran indeholder poriner, der danner åbne vandige kanaler, der tillader fri passage af ioner og små molekyler. strukturanalyse har indikeret, at porinerne ikke indeholder hydrofobe a-spiralformede regioner., I stedet krydser de membranen som β-tønder, hvor 16 β-ark foldes op i en tøndelignende struktur, der omslutter en vandig pore (figur 12.9). Sidekæderne af polære aminosyrer linjer porerne, mens sidekæder af hydrofobe aminosyrer interagerer med det indre af membranen. Porinmonomerne associeres til at danne stabile trimere, der hver indeholder tre åbne kanaler, gennem hvilke polære molekyler kan diffundere over membranen.

figur 12.9
struktur af en porinmonomer., Hver monomer er en β-tønde bestående af 16 antiparallelle β-tråde (pile). Den øverste ende af molekylet vender mod det ydre medium. (Fra H. Nikaido, 1994. J. Biol. Chem. 269: 3905.)
i modsætning til transmembrane proteiner forankres en række proteiner (hvoraf mange opfører sig som integrerede membranproteiner) i plasmamembranen ved kovalent bundet lipider eller glycolipider (figur 12.10). Medlemmer af en klasse af disse proteiner indsættes i den ydre indlægsseddel af plasmamembranen ved hjælp af glycosylphosphatidylinositol (GPI) ankre., GPI-ankre sættes til visse proteiner, der er overført til det endoplasmatiske retikulum og forankres i membranen ved hjælp af et C-terminal transmembranområde (se figur 9.16). Transmembranområdet spaltes, når GPI-ankeret tilsættes, så disse proteiner forbliver kun fastgjort til membranen af glycolipidet. Da polypeptidkæderne af GPI-forankrede proteiner overføres til det endoplasmatiske retikulum, glykosyleres de og udsættes på overfladen af cellen efter transport til plasmamembranen.
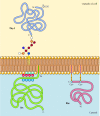
Figur 12.,10
eksempler på proteiner, der er forankret i plasmamembranen af lipider og glycolipider. Nogle proteiner (f.lymfocytproteinet Thy-1) forankres i den ydre indlægsseddel af plasmamembranen ved hjælp af GPI-ankre tilsat til deres C-ende i det endoplasmatiske retikulum. (mere…)
andre proteiner forankres i den indre indlægsseddel af plasmamembranen ved kovalent bundet lipider. I stedet for at blive behandlet gennem den sekretoriske vej syntetiseres disse proteiner på frie cytosoliske ribosomer og modificeres derefter ved tilsætning af lipider., Disse ændringer omfatter tilsætning af myristinsyre (en 14-carbon-fedtsyre) til amino endestation polypeptid kæde, tilsætning af palmitinsyre (16 kulstofatomer) til den side, der er kæder af cystein rester, og tilføjelsen af prenyl grupper (15 eller 20 kulstofatomer) til den side, der er kæder af carboxy-terminal cystein-rester (se figur 7.29, 7.30 og 7.31). I nogle tilfælde er disse proteiner (hvoraf mange opfører sig som perifere membranproteiner) målrettet mod plasmamembranen af positivt ladede områder af polypeptidkæden såvel som af de vedhæftede lipider., Disse positivt ladede proteindomæner kan interagere med de negativt ladede hovedgrupper af phosphatidylserin på den cytosoliske overflade af plasmamembranen. Det er bemærkelsesværdigt, at mange af proteinerne, der er forankret i den indre indlægsseddel af plasmamembranen (inklusive Src-og Ras-proteinerne illustreret i figur 12.10), spiller vigtige roller i transmission af signaler fra celleoverfladereceptorer til intracellulære mål, som diskuteret i næste kapitel.