En titrering er en volumetrisk teknik, hvor en løsning af en reaktant (den titrant) føjes til en løsning af en anden reaktant (den “analyt”), indtil den ækvivalens punkt er nået. Ækvivalens punkt er det punkt, hvor titrant er blevet tilføjet i nøjagtig den rigtige mængde til at reagere støkiometrisk med analytten (når mol titrant = mol analyt). Hvis enten titranten eller analytten er farvet, er ækvivalenspunktet tydeligt fra forsvinden af farve, når reaktanterne forbruges., Ellers kan der tilføjes en indikator, der har et “endpoint” (skifter farve) ved ækvivalenspunktet, eller ækvivalenspunktet kan bestemmes ud fra en titreringskurve. Mængden af tilsat titrant er bestemt ud fra dens koncentration og volumen:
n (mol) = C (mol/L) * V (L)
og mængden af titrant kan bruges i den sædvanlige støkiometrisk beregning til at bestemme mængden af analytten.
titreringsprocessen kan observeres i videoen nedenfor.,
et målt volumen af den opløsning, der skal titreres, i dette tilfælde anbringes farveløs vandig eddikesyre, CH3COOH(A.) i et bægerglas. Det farveløse natriumhydro .id NaOH(A.), som er titranten, tilsættes omhyggeligt ved hjælp af en buret. Mængden af tilsat titrant kan derefter bestemmes ved at læse væskeniveauet i buret før og efter titrering. Denne læsning kan normalt estimeres til nærmeste hundrededel af en milliliter, så præcise tilsætninger af titrant kan foretages hurtigt.,
da de første få milliliter titrant strømmer ind i kolben, ændres en vis indikator kort til lyserød, men vender hurtigt tilbage til farveløs. Dette skyldes et stort overskud af eddikesyre. Den begrænsende reagens NaOH forbruges fuldstændigt.
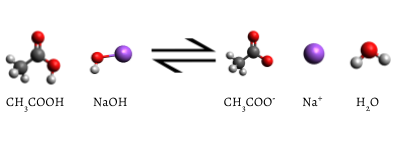
den tilsatte indikator ændres til lyserød, når titreringen er afsluttet, hvilket indikerer, at al den vandige eddikesyre er blevet konsumeret af NaOH(a.). Reaktionen, der forekommer, er
\
til sidst forbruges Al eddikesyre., Tilsætning af selv en brøkdel af en dråbe titrant frembringer en varig lyserød farve på grund af ureageret NaOH i kolben. Farveændringen, der forekommer ved indikatorens slutpunkt, signalerer, at al eddikesyre er forbrugt, så vi har nået ækvivalenspunktet for titreringen. Hvis der blev tilsat lidt mere NaOH-opløsning, ville der være et overskud, og farven på opløsningen i kolben ville blive meget mørkere. Slutpunktet vises pludselig, og man skal passe på ikke at overskride slutpunktet.
efter titreringen har nået endepunktet, aflæses et slutvolumen fra buret., Ved hjælp af den første og sidste læsning, mængden af tilsat kan bestemmes helt præcist:
formålet med en titrering er altid at tilføje kun den mængde titrant, der er nødvendig for at forbruge nøjagtigt den mængde stof, der titreres. I NaOH-CH3COOH-reaktionen e.. \(\ref{2}\) forekommer ækvivalenspunktet, når der er tilsat en lige molær mængde NaOH fra den graduerede cylinder for hver mol CH3COOH, der oprindeligt var i titreringskolben., Det vil sige ved ækvivalenspunktet forholdet mellem mængden af NaOH, der tilsættes til mængden af forbrugt CH3COOH, skal svare til det støkiometriske forhold
\
titrering bruges ofte til at bestemme koncentrationen af en opløsning. I mange tilfælde er det ikke en enkel sag at opnå et rent stof, veje det nøjagtigt og opløse det i en volumetrisk kolbe, som det blev gjort i Eksempel 1 i Opløsningskoncentrationer. NaOH, for eksempel, kombinerer hurtigt med H2O og CO2 fra luften, og så selv en frisklavet prøve af fast NaOH vil ikke være ren., Dens vægt ville ændre sig kontinuerligt, da CO2 (g) og H2O(g) blev absorberet. Hydrogenchlorid (HCl) er en gas ved almindelige temperaturer og tryk, hvilket gør det meget vanskeligt at håndtere eller veje. Vandige opløsninger af begge disse stoffer skal standardiseres, dvs. deres koncentrationer skal bestemmes ved titrering.
langt den mest almindelige anvendelse af titreringer er ved bestemmelse af ukendte, det vil sige ved bestemmelse af koncentrationen eller mængden af stof i en prøve, som vi oprindeligt ikke vidste noget om. Det næste eksempel omfatter en ukendt, at mange mennesker støder på hver dag.,
de 308, 0 mg, der er opnået i dette eksempel, er i rimelig tæt overensstemmelse med producentens krav på 300 mg. Tabletterne er stemplet ud af maskiner, ikke vejes individuelt, og så forventes en vis variation.