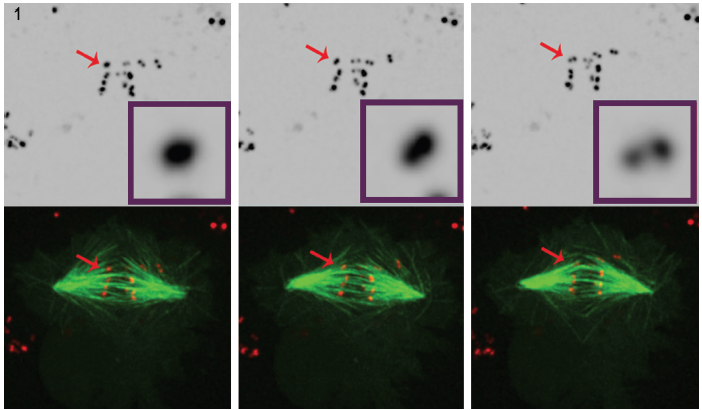
Obrázek 1. Tři Vybrané snímky z videosekvence z POLO-vyčerpané buňky jasně ukazují, že v průběhu času, intenzivní centromerou/kinetochorům signál (červená) řeší do pár bodů, které ukazuje,, že chromozomy jsou syntelically připojené k spindle mikrotubuly (zelená). Datové sady fluorescenční mikroskopie 4D byly shromažďovány každých 30 sekund s 0.,5 mm z-kroky zahrnující celý objem buněk pomocí 100°, 1.4 NA plán-apochromatic cíl na 25°C s Andora Revoluce rotující disk konfokální jednotky a dixonem EMCCD kamera, obě jsou poháněny Andor IQ live-cell imaging software.
mitotické buněčné dělení závisí na schopnosti buněk správně distribuovat sesterské chromatidy do tvářecích buněk. Pro spolehlivé provedení funkce buňky používají vnitřní editační mechanismy k opravě nepřesných příloh chromozomů / vřetenových vláken., Spárované kinetochores jsou obvykle zarovnány správně připojit vřeteno vlákna a oddělit chromatinu, nicméně, chybné a nevyrovnané kinetochores udělat výsledek. Buňky obsahují specializované editační mechanismy, které zabraňují a opravují tyto špatně zarovnané páry kinetochorů, i když přesný mechanismus není dobře pochopen 1,2 ., Předpokládá se, Tatiana Moutinho-Santos na Universidade do Porto, Portugalsko Instituto de Biologia Molecular e Celular (IBMC), že přítomnost POLO kinázy je nezbytná na podporu chromozomu bi-orientace (nazval amphitelic uspořádání), a tím zachovat správné kinetochorům zarovnání.
, Aby lépe pochopit jeho roli v regulaci kinetochorům rozvoj, Dr. Moutinho dos Santos studoval vyčerpané Drosophila POLO kinázy v rámci živé buňky doložit POLO je zapojení do editační funkce potřebné k udržení amphitelic kinetochorům uspořádání., V tomto případě bylo studováno syntelistické uspořádání (sesterské kinetochory připojené k mikrotubulům vycházejícím ze stejného vřetena). Timelapse analýzy mitózy byla provedena na Drosophila S2 buněk stabilně exprimujících CID-mCherry pro vizualizaci centromery, a GFP–tubulinu na mikrotubuly. Vizualizace kinetochorů je náročná vzhledem k jejich malé velikosti, nízkému fluorescenčnímu signálu a krátkému vzhledu během dělení buněk. Konfokální fluorescenční mikroskopie se často používá k obrazovým kinetochorům, avšak i v tomto prostředí zůstává vizualizace obtížná., Kinetochory jsou velmi malé (300 nm)3, blízké bočním rozlišovacím schopnostem světelného mikroskopu a překračují axiální rozlišovací schopnost mikroskopu. Kromě toho zobrazování fluorescenčních markerů v živých buňkách představuje potenciální fototoxické a fotobleachingové účinky. Intenzivní laserové osvětlení může vytvářet problémy s fototoxicitou, zejména škodlivé pro život, dělící buňky.
Andor Revoluce XD rotující disk konfokální mikroskopie je zaměstnán překonat Dr. Moutinho dos Santo jedinečné výzvy spojené s pozorováním kinetochores., V tomto případě, čtyři samostatné faktory musí být současně adresována přiměřeně vizualizaci dynamických buněčných procesů:
- Rychlost akvizice
- Prostorová a časová rozlišovací schopnost
- schopnost detekovat velmi nízké fluorescenční úrovní intenzity
- Řízení k dispozici fluorescenční signál
Tato témata prostorových, časové a intenzita, rozlišení často opakují, s fluorescenční mikroskopie a jsou často v rozporu s experimenty zahrnující sledování životaschopnosti buněk., Například dlouhé expozice fotoaparátu a prodloužené doby osvětlení s vysokou intenzitou vytvářejí fototoxické účinky, které poškozují nebo ničí živé buňky. Současně lehce označené mikrostruktury vyžadují delší expozici k vizualizaci, ale mohou být nepříznivě ovlivněny fotobleachingem. Složením problému je potřeba kombinovat tradiční trojrozměrná data s časem. Nakonec zůstává nutné rozeznat signál od šumu pozadí a Outof-focus haze.
rychlost získávání má zvláštní význam pro Dr. Mountinho dos Santos., Kontrolní buňky S2 vykazují dělící cyklus přibližně 30 minut. Buňky Polo depleted S2 používané v jejích experimentech však vykazovaly zatčené období přesahující osm hodin. Nahrávání POLO vyčerpané buněčné dělení vyžaduje sbírka mezi 7,200 a 12.000 sad obrázků (dva fluorochromes zobrazen každých třicet sekund pro jednu až pět hodin, získané na 0,5 mikronů axiální kroků na až 20 stupňů, pro axiální kinetochorům rozlišení)., Konvenční fluorescenční mikroskopie a laserové osvětlení neumožní ani požadavky na jemné osvětlení, ani rychlost získávání k dokončení tohoto časově citlivého úkolu. Například laserové rastrování v tradiční konfokální mikroskopii vyžaduje delší časové období pro sběr signálu ze vzorku. Spřádací diskové konfokální systémy se používají k překonání těchto tradičních bariér a k odhalení nových poznatků o technikách úpravy molekulárních kinetochorů.,
ve Srovnání s běžnými widefield fluorescenční systémy, prostorové rozlišení rotující disk konfokální je vynikající v obou bočních (x a y) a axiální (z) dimenze. Prostřednictvím neustálého skenování dírkového pole lze vzorky prohlížet v reálném čase při vysokém kontrastu a poskytovat jasné obrazy v difrakčních mezích optiky mikroskopu. To umožňuje 3D vizualizaci a chápání dynamického kinetochorům chování ve vztahu k mikrotubuly vřeténka., Kinetochorům a centromerou laterální rozlišení 300 nm a vřeteno vlákno rozlišení 300 až 500 nm byly zaznamenány a jsou uvedeny v Obrázek a.
Intenzita Rozlišení
Vizualizace fluorescenčně značené kinetochores spojené s každou centromerou klade další nároky na pořízení systému. Studované centromery a kinetochory jsou primárně viditelné pouze během interfázy buněčného dělení. Jak buňky procházejí prorokem, centromery se již vyřešily do drosophilových typických dvanácti chromozomových párů., Správa dostupného světelného rozpočtu během zdlouhavého získávání vyžaduje jemné osvětlení a vysoké rozlišení schopné otáčením diskových technik. Tyto výhody poskytují otvory uvnitř spřádací diskové jednotky. Protože světlo vzrušuje fluorofory pouze tehdy, když je přítomen otvor, jsou fototoxické účinky minimalizovány. Zatímco kontraintuitivní, Snížený rozpočet světla nenaznačuje slabé, těžko rozpoznatelné objekty. Rozlišení intenzity se zvyšuje vyloučením rotujícího disku ze zaostřovacího signálu a následným zesílením signálu architekturou kamery EMCCD., To vytváří novou možnost generovat vyšší kontrastní obrazy odhalující vývoj a zarovnání propíchnutých objektů, jako jsou kinetochory.
závěry
použití technologie spřádacího disku v aplikaci Dr. Mountinho dos Santos live cell vedlo k důležitému pozorování. Při absenci POLO kinázy bylo prokázáno, že buňky Drosophila postrádají korekční mechanismy nezbytné k udržení uspořádání amfitelových chromozomů., Ukázalo se, že přítomnost POLO poskytuje správné prostředí pro správnou architekturu centromere a současně zajišťuje správnou biologickou orientaci chromozomů. Kultivované Drosophila buňky podstupující mitózu v nepřítomnosti POLO kinázy chromozomů připevněte na vřeteno vlákna s syntelic orientace, tj. s sestra kinetochores připojen na mikrotubuly, které pocházejí z jednoho vřetena tyč.
Tento závěr byl vypracován po pečlivé analýze 4D fluorescenční mikroskopie v buňkách exprimujících fluorescenčně značené centromerou/ kinetochorům značku a mikrotubuly. (Obrázek 1).