US Pharm. 2020;45(9):27-29.
ABSTRAKT: Od syntetických hormonů byly poprvé spojeny v roce 1940, hormonální substituční terapie byla široce používán ženami zažívá nežádoucí příznaky menopauzy. Pozdější výzkum vedl k objevům několika negativních účinků spojených s užíváním hormonální terapie, což vyvolalo diskuse o rizika a přínosy hormonální léčby., Protože rizika spojená s komerční přípravky, zhoršuje hormonální terapie (CHT) stal se více prominentní, jako byl nabízený jako biologicky ekvivalentní alternativa k syntetické hormony. Nicméně, kvůli minimálnímu až žádnému dohledu FDA v oblasti míchání obecně, CHT nemusí být tak bezpečné, jak bylo inzerováno. V roce 2018 se Bijuva na základě příznivých výsledků studií stala první BIOIDENTICKOU kombinací schválenou FDA 17-beta estradiol-progesteron.,
po celá desetiletí se ženy obrátily na hormonální substituční terapii k léčbě nežádoucích vazomotorických příznaků spojených s menopauzou, jako jsou návaly horka a noční pocení. Ženy mohou strávit až jednu třetinu svého života v hormon-nedostatek státu, což dále přispívá k takové nežádoucí účinky jako změny nálady, zvýšené riziko osteoporózy a snížení libida. Systémový estrogen je nejúčinnější léčbou vazomotorických příznaků, zatímco genitourinární příznaky spojené s menopauzou by měly být léčeny lokálním estrogenem s nízkou dávkou.,1 pozorovací studie zdraví žen v celé zemi zjistila, že u žen dochází k vazomotorickým příznakům v průměru 7, 4 roku po menopauze.2 většina lékařů však doporučuje, aby léčba trvala déle než 5 let po menopauze a důrazně doporučuje vyhnout se hormonální terapii u žen starších 60 let.1 lékař by měl pečlivě zvážit rizika a výhody spojené s syntetické a dále hormony a zároveň mít na paměti, že primární cíl zlepšit kvalitu života pacientů.,
Bioidentical Hormony
Bioidentical hormony, jako estrogeny, progestiny a androgeny, jsou sloučeniny, které jsou připraveny podle USP Kapitola <795> Nesterilní Slučování norem. Tyto hormony mohou být obsaženy různé dávky a lékové formy, vytváří mnoho možností pro ženy, zájem umocněn hormonální terapie (CHT)., Ještě umocněn formulace nejsou podrobeny přísné výrobní a čistoty standardy testování, že jejich FDA-schválené protějšky udělat; nicméně, i přes to neregulované prostředí, CHT je velmi populární s pacienty, kteří hledají více „osobní“ medicíny.
Endokrinní společnost definovala složené bioidentické hormony jako “ sloučeniny, které mají přesně stejnou chemickou a molekulární strukturu jako hormony produkované v lidském těle.,“3 FDA tvrdí, že termín bioidentical hormonální je čistě marketingové strategie, stejně jako neexistuje žádný vědecký základ pro implicitní užitek, nebo snížení rizika pro CHT přes FDA-schválené syntetické hormonální terapie.3
Syntetické Hormonální Terapie
FDA schválila diethylstilbestrol v roce 1941 a konjugované ekvinní estrogeny (CEE) v roce 1942 k léčbě menopauzálních příznaků.4 počínaje 1960, prodej estrogenu vyletěl až do roku 1975, kdy se objevily zprávy, že užívání estrogenu může být spojeno se zvýšeným rizikem rakoviny endometria.,4 Tyto zprávy však byly do značné míry ignorovány a používání estrogenu pokračovalo. Až do roku 1996, kdy byla publikována studie postmenopauzálních intervencí Estrogen/Progestin (PEPI), začali poskytovatelé zdravotní péče skutečně chápat potenciální negativní účinky spojené s estrogenovou terapií. PEPI byl 3-rok randomizované, placebo-kontrolované, dvojitě zaslepené, multicentrické studii, která zkoumala histologické endometriální účinky léčby s syntetické unopposed estrogenu versus tři různé režimy syntetický estrogen plus progestin.,5
V PEPI soudu, výrazně více jedincům podáván estrogen sám vyvinul jednoduchý, komplexní nebo atypické hyperplazie endometria oproti subjektů, kterým bylo podáváno placebo (TABULKA 1). Kromě toho, zatímco přesná procenta nebyla specifikována, míra hyperplazie u subjektů, kterým byl podáván jeden ze tří režimů estrogen-plus-progestin, byla podobná jako u subjektů, kterým bylo podáváno placebo.5 stručně řečeno, podávání samotného estrogenu v dávce 0.,625 mg denně vedlo k výrazně zvýšená incidence hyperplazie endometria, vzhledem k tomu, kombinace CEE s progestin chráněné endometria z přerůstání do značné míry.5 vzhledem k tomuto prokázanému riziku rakoviny endometria je progestin vždy podáván v kombinaci s estrogenem u žen s intaktní dělohou. Další potvrzení tohoto rizika, 2007 série případů popsat tři ženy, které používají CHT obsahující subterapeutické dávky progestinu a později vyvinula endometriální rakoviny.,6.
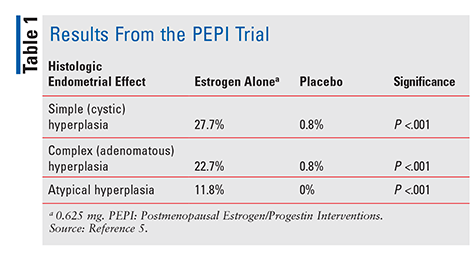
PEPI soudu, spolu s výsledky na 16,068 postmenopauzálních žen od Žen Health Initiative (WHI), publikoval v roce 2002, vrhnout světlo na závažné obavy v roce 1970.7 i když PEPI studie ukázala zvýšené riziko hyperplazie s kombinací produktu, WHI zjištěno výrazně zvýšené riziko spojené s syntetický hormon použití, jako jsou kardiovaskulární onemocnění, cévní mozkové příhody, tromboembolie a karcinomu prsu.,7 U 1 roku po ukončení léčby kombinací CEE/medroxyprogesteronacetátu bylo 80% zvýšené riziko kardiovaskulárních onemocnění a 37% zvýšené riziko ischemické cévní mozkové příhody během intervenční fáze s kombinovanou terapií. Během intervence bylo také významně zvýšeno riziko rakoviny prsu (24%). Estrogen plus progestin užití se poskytují některé výhody, pacienti poznamenat, snížení výskytu vaginální atrofie, snížení vazomotorických příznaků, jako jsou návaly horka a noční pocení, a 38% snížení rizika kolorektálního karcinomu v průběhu léčby u kombinované terapie.,7 nicméně, vzhledem k významu zvýšeného rizika rakoviny prsu a tromboembolických příhod, studie byla zastavena brzy.
Zhoršuje Hormonální Terapie
rizika diskutovali nad vydláždil cestu pro CHT advokacie, protože to bylo si myslel, že přizpůsobení nebo přizpůsobení CHT jednotlivé pacientce by se maximalizovat výhody a minimalizovat riziko. Tvrdí, že CHT byl bezpečnější a biologicky přátelštější, a jeho použití se zvýšilo., Pinkerton a Santoro použili dva různé průzkumy-Harris a Rose-k posouzení znalostí pacientů o CHT a kvantifikaci použití CHT versus FDA schválená hormonální terapie.8 Výsledky Harris průzkum ukázal, že 86% žen ve věku od 40 do 65 let byli vědomi toho, že CHT nebyl schválen FDA, a extrapolovat výsledky z Růže průzkum navrhl, že ročně až 2,5 milionu žen starších než 40 let, může použít CHT.8 údaje z obou průzkumů ukázaly, že lékař nebo lékárník doporučil CHT., Tyto výsledky naznačují, že existuje příležitost pro poskytovatele služeb, aby se zajistilo, že pacienti jsou informováni o výrobku, které jsou příjemcem, včetně všech možných rizik spojených s hormonální terapie, a pro skládání lékárníky, aby se zajistilo, že jsou přináší terapeuticky čistý produkt, který pacienti mohou důvěřovat.
protože FDA není zodpovědná za standardizaci složených produktů, regulace často spadá do státních lékárenských správ., Tyto desky obvykle nemají prostředky na provádění pravidelných kontrol úročených lékáren, a FDA zasahuje pouze tehdy, když je podána stížnost.9 i když ještě umocněn formulace nejsou ze zákona povinni nést riziko varování, teoreticky tyto výrobky mohou představovat stejná rizika, jako jsou ty výše zmíněné, pro syntetické hormonální terapie. K dnešnímu dni však nedošlo k žádným bezpečnostním zkouškám CHT versus syntetické hormony.,10.
k Dispozici jsou tři typy estrogenů, může žena přijímat jako součást zhoršuje hormonální substituční režim: estron (E1), estradiol (E2) a estriol (E3), z nichž každý má různou míru energie (E2 > E1 > E3).9 protože soupeří o stejný receptor, tyto estrogeny působí jako konkurenční inhibitory, což vede ke snížení účinnosti, pokud nejsou správně vyvážené.,11 z toho vyplývá, zastánci CHT vyvinutý Biest (E2 + E3 v 20/80 formulace) a Terstu (E1 + E2 + E3 v 10/10/80 formulace) s cílem maximalizovat fyziologické energie, ale v současné době neexistuje žádný důkaz na podporu tvrzení, že tyto formulace v těchto poměry nepředstavují žádnou bezpečnostní výhodu ve srovnání s syntetické hormonální terapie.11.
i když na celý CHT byla nedostatečně studoval a neregulované, v říjnu 2018, a to na základě zjištění z DOPLNĚNÍ soudu, Bijuva se stal prvním FDA-schválené bioidentical kombinaci 17-beta estradiol progesteron formulace., DOPLNĚNÍ, fáze III, randomizovaná, dvojitě zaslepená, placebem kontrolované, multicentrické studii zkoumali účinnost, endometriální bezpečnost a celkovou bezpečnost čtyři různé dávky jediného 17-beta estradiol-progesteronu kapsle pro středně závažné až závažné vazomotorické příznaky u žen po menopauze.12 primárním bezpečnostním koncovým bodem byl výskyt hyperplazie endometria po 12 měsících. Po 12 měsících nebyly pozorovány žádné případy endometriální hyperplazie pro kteroukoli z dávkových formulací estradiolu a progesteronu.,12 po 12 týdnech prokázala formulace estradiolu 1 mg–progesteronu 100 mg největší statisticky významné snížení frekvence a závažnosti vazomotorických symptomů ve srovnání s placebem při zachování primárních standardů bezpečnosti a koncového bodu.12 Jak již bylo zmíněno, nebyly provedeny žádné studie porovnávající bezpečnost syntetických hormonů oproti formulacím bioidentických hormonů, takže teoreticky rizika zůstávají.,
Závěr
na Základě DOPLNĚNÍ soudu, pre-, peri-a postmenopauzálních žen, nyní máte standardizované, regulované, bioidentical, FDA-schválené léčby vazomotorické symptomy. Budoucí zkoušky jsou potřebné k úplnému vymezení bezpečnostního profilu 17-beta estradiolu a CHT. Lékárníci by měli doporučit jakoukoli perorální hormonální formulaci po co nejkratší dobu., Kromě toho, pokud CHT je vybrán, lékárníci by měli zajistit, aby jejich pacienti vědí, co CHT je a jak se liší od syntetických hormonů a zároveň mají upřímný rozhovor o výhodách a rizicích hormonální substituční terapie.
1. Martin KA, Manson JE. Přístup k pacientovi s menopauzálními příznaky. J Clin Endocrinol Metab. 2008;93(12):4567-4575.
2. Avis NE, Crawford SL, Greendale G, et al. Trvání menopauzálních vazomotorických příznaků během přechodu menopauzy. JAMA stážista Med. 2015;175(4):531-539.
3. Santoro N, Braunstein GD, Butts CL, et al., Složené bioidentické hormony v endokrinologické praxi: vědecké prohlášení Endokrinní společnosti. J Clin Endocrinol Metab. 2016;101(4):1318-1343.
4. Stefanick ml. Estrogeny a progestiny: pozadí a historie, trendy v používání a pokyny a režimy schválené americkým Úřadem pro potraviny a léčiva. Jsem J Med. 2005; 118 (suppl 12B):64-73.
5. Psaní skupiny pro proces PEPI. Účinky hormonální substituční terapie na histologii endometria u žen po menopauze. Postmenopauzální intervence Estrogen/Progestin (PEPI). Jamo. 1996;275(5):370-375.
6., Eden JA, Hacker NF, Fortune M. tři případy rakoviny endometria spojené s“ bioidentickou “ hormonální substituční terapií. Med J Aust. 2007;187(4):244-245.
7. Rossouw JE, Anderson GL, Prentice RL, et al. Rizika a přínosy estrogenu Plus progestinu u zdravých postmenopauzálních žen: hlavní výsledky z iniciativy zdraví žen randomizovaná kontrolovaná studie. Jamo. 2002;288(3):321-333.
8. Pinkerton JV, Santoro N. ještě Umocněn bioidentické hormonální terapie: zjišťování použití, trendy a mezery ve znalostech mezi NÁMI ženy. Menopauza. 2015;22(9):926-936.
9. Bhavnani BR, Stanczyk FZ., Mylná představa a obavy z bioidentických hormonů používaných pro hormonální terapii na zakázku. J Clin Endocrinol Metab. 2012;97(3):756-759.
10. Bijuva (estradiol a progesteron) příbalová informace. Boca Raton, FL: TherapeuticsMD, Inc; listopad 2019.
11. Kuhl h. farmakologie estrogenů a progestogenů: vliv různých způsobů podávání. Klimakterické. 2005; 8(suppl 1): 3-63.
12. Lobo RA, Archer DF, Kagan R, et al. Perorální kapsle 17beta-estradiol-progesteron pro vazomotorické příznaky u žen po menopauze: randomizovaná kontrolovaná studie. Obstet Gynecol., 2018;132(1):161-170.
obsah obsažený v tomto článku je pouze pro informační účely. Obsah není určen jako náhrada za odborné poradenství. Spoléhání se na jakékoli informace uvedené v tomto článku je výhradně na vaše vlastní riziko.