Membránových Proteinů
Zatímco lipidy jsou základní stavební prvky membrány, proteiny jsou odpovědné za provádění specifické membránové funkce. Většina plazmatických membrán se skládá z přibližně 50% lipidů a 50% hmotnostních bílkovin, přičemž sacharidové části glykolipidů a glykoproteinů tvoří 5 až 10% hmotnosti membrány. Vzhledem k tomu, že proteiny jsou mnohem větší než lipidy, toto procento odpovídá přibližně jedné proteinové molekule na každých 50 až 100 molekul lipidů., V roce 1972 Jonathan Singer a Garth Nicolson navrhli model fluidní mozaiky membránové struktury, který je nyní obecně přijímán jako základní paradigma pro organizaci všech biologických membrán. V tomto modelu jsou membrány považovány za dvourozměrné tekutiny, ve kterých jsou proteiny vloženy do lipidových dvojvrstvů (obrázek 12.3).

Obrázek 12.3
Fluidní mozaikový model plazmatické membrány., Integrální membránové proteiny jsou vloženy do lipidové dvojvrstvy, zatímco periferní proteiny jsou vázány na membránu nepřímo interakcemi protein-protein. Většina integrálních membránových proteinů je transmembránová (více…)
Singer a Nicolson rozlišit dva druhy membrány-asociovaných proteinů, které se nazývají periferní a integrální membránové proteiny., Periferní membránové proteiny jsou funkčně definovány jako proteiny, které disociují z membrány následující procedury s polární činidla, jako je řešení extrémní pH nebo vysoká koncentrace soli, které nemají narušení fosfolipidové dvojvrstvy. Po disociaci z membrány jsou proteiny periferní membrány rozpustné ve vodných pufrech. Tyto proteiny nejsou vloženy do hydrofobního vnitřku lipidové dvojvrstvy. Místo toho jsou nepřímo spojeny s membránami prostřednictvím interakcí bílkovin a bílkovin., Tyto interakce často zahrnují iontové vazby, které jsou narušeny extrémním pH nebo vysokou solí.
na rozdíl od periferní membránové proteiny, integrální membránové proteiny mohou být uvolněny pouze na ošetření, které narušují fosfolipidové dvojvrstvy. Části těchto integrální membránové proteiny jsou vloženy do lipidové dvojvrstvy, takže mohou být odděleny pouze činidel, které narušují hydrofobní interakce., Nejčastěji používaná činidla pro solubilizace integrální membránové proteiny jsou detergenty, které jsou malé amphipathic molekuly obsahující hydrofobní a hydrofilní skupiny (Obrázek 12.4). Hydrofobní části detergentů vytlačují membránové lipidy a váží se na hydrofobní části integrálních membránových proteinů. Protože druhý konec molekuly detergentu je hydrofilní, komplexy detergentu a bílkovin jsou rozpustné ve vodných roztocích.

obrázek 12.4
solubilizace integrálních membránových proteinů detergenty., Detergenty (např. oktylglukosid) jsou amfipatické molekuly obsahující hydrofilní skupiny hlavy a hydrofobní ocasy. Hydrofobní ocasy se vážou na hydrofobní oblasti integrální membrány (více…)
mnoho integrálních proteinů jsou transmembránové proteiny, které pokrývají lipidovou dvojvrstvu s částmi vystavenými na obou stranách membrány. Tyto proteiny lze vizualizovat v elektronových mikrografech plazmatických membrán připravených technikou zmrazení a zlomeniny (viz obrázek 1.35). V těchto vzorcích je membrána rozdělena a oddělena do dvou letáků., Transmembránové proteiny jsou pak patrné jako částice na vnitřních plochách membrány (obrázek 12.5).

obrázek 12.5
freeze-fracture electron micrograph lidských membrán červených krvinek. Částice v membráně jsou transmembránové proteiny. (Harold H. Edwards / Visuals Unlimited.,)
membrane-spanning části transmembránové proteiny jsou obvykle α šroubovice 20 až 25 hydrofobní aminokyseliny, které jsou vloženy do membrány endoplazmatického retikula v průběhu syntézy polypeptidového řetězce (viz obrázek 9.11, 9.12 a 9.13). Tyto proteiny jsou pak transportovány v membránových váčcích z endoplazmatického retikula do Golgiho aparátu a odtud do plazmatické membrány., Sacharidů skupiny jsou přidány do polypeptidových řetězců v obou endoplazmatického retikula a Golgiho aparátu, takže většina transmembránových proteinů z plazmatické membrány jsou glykoproteiny s jejich oligosacharidy vystaveny na povrchu buňky.
studie červených krvinek poskytly dobré příklady periferních i integrálních proteinů spojených s plazmatickou membránou. Membrány lidských erytrocytů obsahují asi tucet hlavních proteinů, které byly původně identifikovány gelovou elektroforézou membránových přípravků., Většina z nich jsou proteiny periferní membrány, které byly identifikovány jako složky kortikálního cytoskeletu, který je základem plazmatické membrány a určuje tvar buněk (viz kapitola 11). Například nejhojnější periferní membránový protein červených krvinek je spektrin, což je hlavní cytoskeletální protein erytrocytů. Mezi další periferní membránové proteiny červených krvinek patří aktin, ankyrin a pás 4.1., Ankyrin slouží jako hlavní spojení mezi plazmatické membrány a cytoskeletu vazbou na oba spectrin a integrální membránový protein band 3 (viz Obrázek 11.11). Další souvislost mezi membránu a cytoskelet je poskytována kapela 4.1, který se váže na křižovatkách spektrinu a aktinu, stejně jako glycophorin (další významné integrální protein membrány erytrocytů).
dva hlavní integrální membránové proteiny červených krvinek, glykoforin a pás 3, poskytují dobře studované příklady transmembránové proteinové struktury (obrázek 12.6)., Glykoforin je malý glykoprotein 131 aminokyselin s molekulovou hmotností asi 30 000, z nichž polovina je bílkovina a polovina sacharidů. Glykoforin protíná membránu jedinou membránou-překlenující α spirálu 23 aminokyselin, přičemž její glykosylovaná aminokyselinová koncová část je vystavena na povrchu buňky. Ačkoli glykoforin byl jedním z prvních transmembránových proteinů, které mají být charakterizovány, jeho přesná funkce zůstává neznámá. Naproti tomu funkce ostatních hlavních transmembránových proteinů červených krvinek je dobře pochopena., Tento protein, původně známý jako pás 3, je aniontový transportér zodpovědný za průchod iontů hydrogenuhličitanu (HCO3-) a chloridu (Cl-) přes membránu červených krvinek. Pásový 3 polypeptidový řetězec je 929 aminokyselin a předpokládá se, že má 14 membránových klenutých α-spirálových oblastí. V membráně dimery pásma 3 tvoří kulové struktury obsahující vnitřní kanály, kterými jsou ionty schopny cestovat přes lipidovou dvojvrstvu.
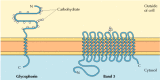
obrázek 12.6
integrální membránové proteiny červených krvinek., Glykoforin (131 aminokyselin) obsahuje jednu transmembránovou α helix. Je silně glyokosylovaný, s oligosacharidy připojenými k 16 místům na extracelulární části polypeptidového řetězce. (mnoho…)
Protože jejich amphipathic charakter, transmembránové proteiny, ukázalo obtížné, jak krystalizovat, jak je požadováno pro trojrozměrné strukturální analýzy X-ray difrakce., První transmembránové bílkoviny, které mají být analyzovány pomocí X-ray krystalografie byla fotosyntetického reakčního centra bakterie Rhodopseudomonas viridis, jehož struktura byla hlášena v roce 1985 (Obrázek 12.7). Reakční centrum obsahuje tři transmembránové proteiny, určené L, M a H (lehké, střední a těžké) podle jejich zdánlivou velikostí indikován pomocí gelové elektroforézy. Podjednotky L A M mají pět membránových klenutých α helixů. Podjednotka H má pouze jednu transmembránovou α spirálu, přičemž většina polypeptidového řetězce je na cytosolické straně membrány., Čtvrtá podjednotka reakčního centra je cytochrom, což je periferní membránový protein vázaný na komplex interakcemi protein-protein.

obrázek 12.7
bakteriální fotosyntetické reakční centrum. Reakční centrum se skládá ze tří transmembránových proteinů, označených L (Červená), M (žlutá) a H (zelená). Podjednotky L A M mají pět transmembránových α helixů, zatímco podjednotka H má pouze (více…)
přestože většina transmembránových proteinů pokrývá membránu α-spirálovými oblastmi, není tomu tak vždy., Dobře charakterizovanou výjimkou jsou poriny-třída proteinů, které tvoří kanály ve vnějších membránách některých bakterií. Mnoho bakterií, včetně E. coli, má duální membránový systém, ve kterém je plazmatická membrána (nebo vnitřní membrána) obklopena buněčnou stěnou a výraznou vnější membránou (obrázek 12.8). Na rozdíl od plazmatické membrány je vnější membrána vysoce propustná pro ionty a malé polární molekuly (v případě E.coli, s molekulovou hmotností až 600). Tato propustnost vyplývá z porinů, které tvoří otevřené vodné kanály přes lipidovou dvojvrstvu., Jak je uvedeno v kapitole 10, proteiny související s bakteriálními poriny se také nacházejí ve vnějších membránách mitochondrií a chloroplastů.
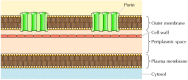
obrázek 12.8
bakteriální vnější membrány. Plazmatická membrána některých bakterií je obklopena buněčnou stěnou a výraznou vnější membránou. Vnější membrána obsahuje poriny, které tvoří otevřené vodné kanály umožňující volný průchod iontů a malých molekul.
strukturální analýza ukázala, že poriny neobsahují hydrofobní α-spirálové oblasti., Místo toho procházejí membránou jako β sudy, ve kterých se 16 β listů skládá do barelovité struktury obklopující vodný pór (obrázek 12.9). Boční řetězce polárních aminokyselin lemují pór, zatímco boční řetězce hydrofobních aminokyselin interagují s vnitřkem membrány. Monomery porinu se spojují a vytvářejí stabilní trimery, z nichž každý obsahuje tři otevřené kanály, kterými mohou polární molekuly difundovat přes membránu.

obrázek 12.9
struktura monomeru porinu., Každý monomer je β barel sestávající z 16 antiparalelních β pramenů (šipek). Horní konec molekuly směřuje k vnějšímu médiu. (Od H. Nikaida, 1994. J. Biol. Chem. 269: 3905.)
na rozdíl od transmembránové proteiny, řadu proteinů (z nichž mnohé se chovají jako integrální membránové proteiny) jsou ukotveny v plazmatické membráně pomocí kovalentně připojených lipidy nebo glykolipidy (Obrázek 12.10). Členové jedné třídy těchto proteinů jsou vloženi do vnější příbalové informace plazmatické membrány kotvami glykosylfosfatidylinositolu (GPI)., Kotvy GPI se přidávají k některým proteinům, které byly přeneseny do endoplazmatického retikula a jsou zakotveny v membráně transmembránovou oblastí C-terminálu (viz obrázek 9.16). Transmembránový regionu se odštěpí jako GPI kotva je přidána, takže tyto proteiny zůstávají připojeny k membráně pouze glykolipidu. Od polypeptidových řetězců GPI-kotvené proteiny jsou převedeny do endoplazmatického retikula, jsou glykosylovaný a vystaveny na povrchu buňky následující transport do plazmatické membrány.
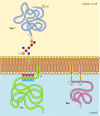
Obrázek 12.,10
příklady proteinů ukotvených v plazmatické membráně lipidy a glykolipidy. Některé proteiny (např. lymfocytární protein Thy-1) jsou ukotveny ve vnější příbalové informaci plazmatické membrány pomocí GPI kotev přidaných do jejich c konce v endoplazmatickém retikulu. (mnoho…)
Ostatní proteiny jsou ukotveny ve vnitřní příbalové informaci plazmatické membrány kovalentně připojenými lipidy. Místo toho, aby byly zpracovány sekreční cestou, jsou tyto proteiny syntetizovány na volných cytosolických ribozomech a poté modifikovány přidáním lipidů., Tyto změny zahrnují přidání kyseliny myristové (14-uhlíku mastné kyseliny) na amino konci polypeptidového řetězce, přidání kyseliny palmitové (16 uhlíků), aby postranní řetězce cysteinu zbytky, a navíc prenyl skupin (15 nebo 20 uhlíků) na boční řetězce karboxy-terminální cystein reziduí (viz obrázek 7.29, 7.30, 7.31). V některých případech, tyto proteiny (z nichž mnohé se chovají jako periferní membránové proteiny) jsou zaměřeny na plazmatické membráně pomocí kladně nabitých oblastí polypeptidový řetězec, stejně jako připojené lipidů., Tyto kladně nabité bílkoviny domény mohou interagovat s negativně nabitými vedoucí skupiny fosfatidylserinu na cytosolový povrchu plazmatické membrány. Je pozoruhodné, že mnohé proteiny ukotveny ve vnitřní informaci k plazmatické membráně (včetně Src a Ras proteiny je znázorněno na Obrázku 12.10) hrají důležitou roli v přenosu signálů z buněčné povrchové receptory intracelulární cíle, jak je popsáno v další kapitole.