dlouhá odpověď. Nejprve je třeba rozlišovat mezi polaritou vazby a polaritou molekuly (nebo sloučeniny).
polarita vazby označuje oddělení elektrického náboje, které je výsledkem rozdílu v elektronegativitě mezi dvěma atomy nebo skupinami, které se spojují dohromady.,
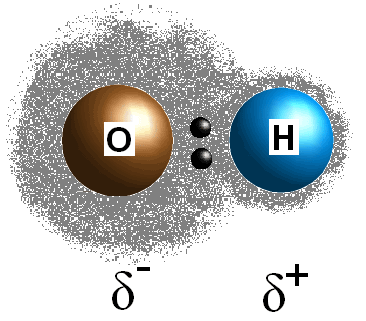
Tento rozdíl v elektronegativitě hodnoty mezi dvěma atomy způsobí, že bond je elektrony, které mají být sdíleny nerovnoměrně, čímž se vytváří pozitivní náboj (#delta^+#) na méně elektronegativní atom a částečný záporný náboj (#delta^(-)#) na elektronegativnější atom. Polarita vazby může být stanovena pouze pomocí hodnot elektronegativity dvou atomů.
Pokud vazba mezi dvěma atomy není polární, tj. rozdíl v elektronegativitě mezi těmito dvěma atomy je menší než 0.,5, pak bude vaše molekula nepolární. Pokud je vazba skutečně polární, můžete zkusit určit polaritu molekuly.
geometrie molekuly je důležitým faktorem při určování polarity molekuly. Tyto výše uvedené dílčí poplatky vedou k okamžiku dluhopisového dipólu, # mu#.
Pokud se orientace těchto vazebných dipólových momentů navzájem zruší, pak se molekula říká, že je nepolární. Pokud však ne, máte co do činění s polární molekulou.,
Některé příklady, kde bond dipólové momenty se navzájem vyruší, což má za následek non-polární molekula.
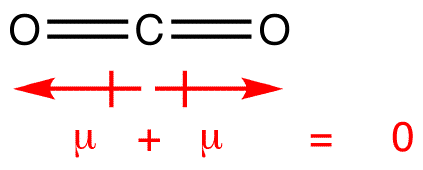
Dipólové momenty jsou vypracovány s šipkou směřující na více elektronegativní atom a druhou stranu na méně elektronegativní atom. Všimněte si, že pro #co_2#, který má dvě polární vazby, je celkový dipólový moment nulový, protože tyto dvě šipky se navzájem ruší. Výsledkem je nepolární molekula., Totéž lze říci pro #BF_3#:
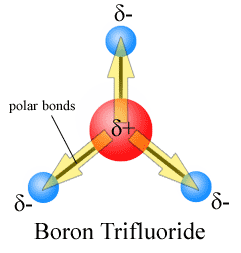
tři dipólové momenty se navzájem vyruší v důsledku symetrického uspořádání dluhopisů (viz více na vektorové sčítání).
assymetrical uspořádání dílčích poplatků výsledků v polární molekuly, jako můžete vidět na vodu:
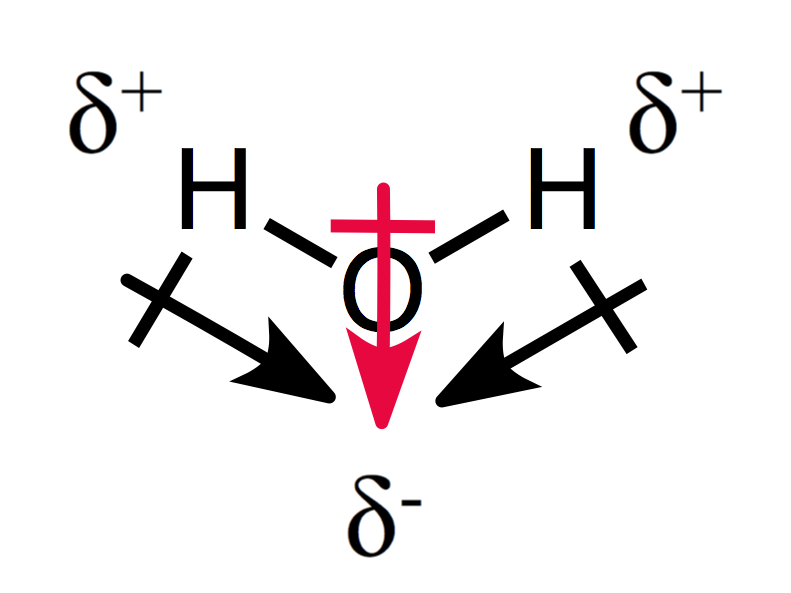
dva dipólové momenty přidat k sobě navzájem vytváří celkový dipólový moment, a proto polární molekula.,
na závěr, aby bylo možné předpovědět molekula je polarita, musíte být obeznámeni s Lewis struktury, elektronegativita, Teorie VSEPR, a bond polarity.