Cíle Vzdělávání
na konci této části, budete moci:
- Popsat, jak elektrony byly objeveny.
- vysvětlete experiment kapky oleje Millikan.
- popište rutherfordův experiment se zlatou fólií.
- popisuje Rutherfordův planetární model atomu.
stejně jako atomy jsou substrukturou hmoty, elektrony a jádra jsou substruktury atomu., Experimenty, které byly použity k zjistit, elektrony a jádry odhalit některé základní vlastnosti atomů a může být snadno zřejmé, pomocí nápady, jako jsou elektrostatické a magnetické síly, které jsou již zahrnuty v předchozích kapitolách.
náboje a elektromagnetické síly
v předchozích diskusích jsme poznamenali, že kladný náboj je spojen s jádry a záporným nábojem s elektrony. Také jsme se zabývali mnoha aspekty elektrických a magnetických sil, které ovlivňují náboje., Budeme nyní zkoumat objev elektronu a jádra jako substruktury atomu a zkoumat jejich příspěvky k vlastnostem atomů.
Elektron

Obrázek 1. Plynová výbojová trubice svítí, když je na ni aplikováno vysoké napětí. Elektrony emitované z katody jsou urychlovány směrem k anodě; vzrušují atomy a molekuly v plynu, které v reakci září., Jednou volal Geissler trubky a později Crookes trubky, oni jsou nyní známé jako katodové trubice (CRTs) a jsou nalezené ve starších televizorů, počítačové obrazovky, a rentgenové přístroje. Při použití magnetického pole se paprsek ohýbá ve směru očekávaném pro záporný náboj. (kredit: Paul Downey, Flickr)
výbojky, jako je to znázorněno na Obrázku 1, se skládá z evakuované skleněné trubice obsahující dvě kovové elektrody a řidší plyn. Když je na elektrody aplikováno vysoké napětí, plyn svítí. Tyto trubky byly předchůdci dnešních neonových světel., Poprvé byly studovány vážně Heinrich Geissler, německý vynálezce a sklář, začíná v roce 1860. Anglický vědec William Crookes, mimo jiné, i nadále studovat, co na nějakou dobu byli povoláni Crookes trubky, kde jsou elektrony uvolněné z atomů a molekul v řídkém plynu uvnitř trubice a jsou urychlovány z katody (záporná) k anodě (kladné) vysoký potenciál., Tyto „katodové paprsky“ srážejí s atomy plynu a molekul a jejich rozrušit, což vede k emisi elektromagnetického (EM) záření, které nutí elektrony cestu viditelné jako paprsek, který se šíří a mizí, jak se pohybuje směrem od katody.
plynové výbojky se dnes nejčastěji nazývají katodové trubice, protože paprsky pocházejí z katody. Crookes ukázal, že elektrony nesou hybnost (mohou otáčet malé pádlové kolo)., Zjistil také, že jejich normálně rovná cesta je ohnutá magnetem ve směru očekávaném pro záporný náboj pohybující se od katody. Jednalo se o první přímé indikace elektronů a jejich náboje.

Obrázek 2. J. j. Thomson (credit: www.firstworldwar.com, via Wikimedia Commons)
anglický fyzik j. J. Thomson (1856-1940) zlepšila a rozšířila rozsah experimentů s výbojky. (Viz Obrázek 2 a obrázek 3.,) Ověřil záporný náboj katodových paprsků magnetickým i elektrickým polem. Navíc shromáždil paprsky v kovovém šálku a našel přebytek negativního náboje. Thomson byl také schopen měřit poměr náboje elektronu k jeho hmotnosti, \frac{q_e}{m_e}\\—důležitý krok k nalezení skutečné hodnoty qe a me. Obrázek 4 ukazuje, katoda-ray trubice, která produkuje úzký paprsek elektronů, který prochází nabíjecí desky připojen k high-napětí napájení., Elektrické pole E je produkován mezi nabíjecí desky, a katoda-ray trubice je umístěna mezi póly magnetu tak, že elektrické pole E je kolmá na magnetické pole B magnetu. Tato pole, která jsou kolmá k sobě, produkují na elektronech protichůdné síly. Jak je popsáno pro hmotnostní spektrometry ve více aplikacích magnetismu, pokud čistá síla způsobená poli zmizí,pak je rychlost nabité částice v = \ frac{E}{B}\., Tímto způsobem Thomson určil rychlost elektronů a poté posunul paprsek nahoru a dolů úpravou elektrického pole.

obrázek 3. Schéma Thomsonovy CRT. (kredit: Kurzon, Wikimedia Commons)

Obrázek 4. Toto schéma ukazuje elektronový paprsek v CRT procházející zkříženými elektrickými a magnetickými poli a způsobuje, že fosfor svítí při nárazu na konec trubice.
Gathering terms, we have \ frac{q_e}{m_e}= \ frac{a}{e}\.,
Co je tak důležité o\ frac{q_e}{m_e}\\, poměru náboje elektronu k jeho hmotnosti? Získaná hodnota je
\displaystyle\frac{q_e}{m_e}=-1.76\krát 10^{11}\text{ C/kg (elektron)}\\
je To obrovské číslo, jako Thomson si uvědomil, a to znamená, že elektron má velmi malou hmotnost. Z galvanického pokovování bylo známo, že k destičce materiálu je zapotřebí asi 108 C/kg, což je faktor asi o 1000 méně než náboj na kilogram elektronů., Thomson šel udělat stejný experiment pro kladně nabité vodíkové ionty (nyní známý být holé protony) a našli poplatek za kilogram asi 1000 krát menší než pro elektron, což znamená, že proton je asi 1000 krát hmotnější než elektron. Dnes víme, přesněji řečeno, že
\displaystyle\frac{q_p}{m_p}=9.58\krát 10^{7}\text{ C/kg (proton)}\\,
kde qp je náboj protonu a mp je jeho hmotnost. Tento poměr (ke čtyřem významným číslům) je 1836krát nižší náboj na kilogram než u elektronu., Vzhledem k tomu, že náboje elektronů a protonů mají stejnou velikost, znamená to mp = 1836me.
Thomson provedl řadu experimentů s rozdílnými plyny v bleskojistku a pomocí jiné metody, jako je fotoelektrický efekt, pro uvolnění elektronů z atomů. Vždy našel stejné vlastnosti pro elektron, což dokazuje, že je nezávislou částicí. Za svou práci, jejíž důležité kusy začal publikovat v roce 1897, získal Thomson Nobelovu cenu za fyziku v roce 1906., Při zpětném pohledu je obtížné ocenit, jak úžasné bylo zjistit, že atom má spodní strukturu. Sám Thomson řekl: „teprve když jsem byl přesvědčen, že experiment z něj nezanechal žádný únik, publikoval jsem svou víru v existenci těl menších než atomy.“
Thomson se pokusil měřit náboj jednotlivých elektronů,ale jeho metoda mohla určit jeho náboj pouze podle očekávaného řádu.
Od Faradayovy experimenty s galvanické pokovování v roce 1830, to bylo známo, že asi 100 000 C / mol bylo zapotřebí, aby se deska jednotlivě ionizované ionty., Vydělením tohoto počtu iontů na mol (tj. číslem Avogadro), které bylo přibližně známo, byl náboj na iont vypočítán tak, aby byl přibližně 1,6 × 10-19 C, v blízkosti skutečné hodnoty.

obrázek 5. Robert Millikanův (credit: Neznámý Autor, prostřednictvím Wikimedia Commons)
Americký fyzik Robert Millikanův (1868-1953) (viz Obrázek 5), se rozhodl vylepšit Thomson experiment pro měření qe a byl nakonec nucen vyzkoušet jiný přístup, který je nyní klasický experiment provádí studentů., Experiment kapky oleje Millikan je znázorněn na obrázku 6.
v experimentu kapky oleje Millikan se z rozprašovače stříkají jemné kapky oleje. Některé z nich jsou nabíjeny procesem a pak mohou být zavěšeny mezi kovovými deskami napětím mezi deskami. V této situaci, je hmotnost kapky je dáno elektrická síla:
m dropg = qe E

Obr. 6., Experiment kapky oleje Millikan produkoval první přesné přímé měření náboje na elektrony, jednu z nejzákladnějších konstant v přírodě. Při stříkání se nabijí jemné kapky oleje. Jejich pohyb je pozorován mezi kovovými deskami s potenciálem aplikovaným proti gravitační síle. Rovnováha gravitačních a elektrických sil umožňuje výpočet náboje na poklesu. Poplatek je zjištěno, quantized v jednotkách -1,6 × 10-19 C, tedy určení přímo obvinění z přebytečné a chybějící elektrony na olejové kapky.,
elektrické pole je produkován aplikované napětí, tedy E=\frac{V}{d}\\, a V je upravena tak, aby jen vyvážit pokles hmotnosti. Kapky mohou být viděny jako body odraženého světla pomocí mikroskopu, ale jsou příliš malé na to, aby přímo měřily jejich velikost a hmotnost. Hmotnost poklesu je určena pozorováním, jak rychle klesá, když je napětí vypnuto. Protože odpor vzduchu je velmi významné pro tyto submikroskopické kapky, více masivní kapky padají rychleji než méně hmotné, a sofistikované sedimentace výpočty mohou odhalit jejich hmotnost., Olej se používá spíše než voda, protože se snadno neodpařuje, a tak je hmotnost téměř konstantní. Jakmile se hmotnost kapky je známo, že náboj elektronu je dána tím, že přeskupí předchozí rovnice:
\displaystyle{q}=\frac{m_{\text{drop}}g}{E}=\frac{m_{\text{drop}}gd}{V}\\,
, kde d je vzdálenost desek a V je napětí, které drží drop bez hnutí. (Stejná kapka může být pozorována několik hodin, aby bylo vidět, že je opravdu nehybná.,) V roce 1913 Millikanův měl měřit náboj elektronu qe s přesností 1%, a je lepší to o faktor 10 během několika let na hodnotu -1.60 × 10-19 C. On také poznamenal, že všechny poplatky jsou násobky základní náboj elektronu a to, že náhlé změny by mohly nastat v němž elektrony byly přidány nebo odstraněny z kapek. Za toto velmi zásadní přímé měření qe a za studium fotoelektrického efektu získal Millikan Nobelovu cenu za fyziku v roce 1923.,
S nábojem známého elektronu a známým poměrem náboje k hmotnosti lze vypočítat hmotnost elektronu. To je
\displaystyle{m}=\frac{q_e}{\left(\frac{q_e}{m_e}\right)}\\
po Dosazení známých hodnot výnosy
\displaystyle{m}_e=\frac{-1.60\krát 10^{-19}\text{ C}}{-1.76\krát 10^{11}\text{ C/kg}}\\
nebo me = 9.11 × 10-31 kg elektronu (hmotnost), kde kolo-chyby byly opraveny., Hmotnost elektronu byla ověřena v mnoha následných experimentech a je nyní známa s přesností lepší než jedna část z jednoho milionu. Je to neuvěřitelně malá hmotnost a zůstává nejmenší známou hmotností jakékoli částice, která má hmotnost. (Některé částice, jako jsou fotony, jsou bez hmotnosti a nemohou být přivedeny k odpočinku, ale cestují rychlostí světla.) Podobný výpočet dává hmotnosti jiných částic, včetně protonu. Na tři číslice, hmotnost protonu je nyní známo, že je mp = 1.67 × 10-27 kg (proton má hmotnost), která je téměř identická s hmotností atomu vodíku., To, co Thomson a Millikan udělali, bylo prokázat existenci jedné substruktury atomů, elektronu a dále ukázat, že má jen nepatrný zlomek hmotnosti atomu. Jádro atomu obsahuje většinu své hmotnosti a povaha jádra byla zcela neočekávaná.
začala se objevovat i další důležitá charakteristika kvantové mechaniky. Všechny elektrony jsou navzájem identické. Náboj a hmotnost elektronů nejsou průměrné hodnoty; spíše jsou to jedinečné hodnoty, které mají všechny elektrony., To platí o jiných základních entitách na submikroskopické úrovni. Všechny protony jsou navzájem totožné a tak dále.
jádro
Zde zkoumáme první přímý důkaz o velikosti a hmotnosti jádra. V pozdějších kapitolách budeme zkoumat mnoho dalších aspektů jaderné fyziky, ale základní informace o jaderné velikosti a hmotnosti jsou tak důležité pro pochopení atomu, který zde považujeme.
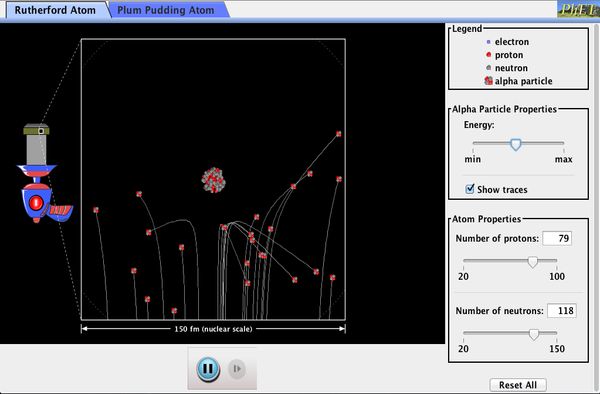
jaderná radioaktivita byla objevena v roce 1896 a brzy byla předmětem intenzivního studia řady nejlepších vědců na světě., Mezi nimi byl Novozélanďan Lord Ernest Rutherford, který provedl řadu základních objevů a získal titul „Otec jaderné fyziky.“Narodil se v Nelson, Rutherford udělal jeho postgraduální studium na Cavendish Laboratoře v Anglii, před nástupem do pozice na McGill University v Kanadě, kde on dělal práci, která mu vynesla Nobelovu Cenu za Chemii v roce 1908. V oblasti atomové a jaderné fyziky existuje mnoho překrývání mezi chemií a fyzikou, přičemž fyzika poskytuje základní teorie umožňující., V pozdějších letech se vrátil do Anglie a jako student měl šest budoucích nositelů Nobelovy ceny. Rutherford použil jaderné záření k přímému zkoumání velikosti a hmotnosti atomového jádra. Experiment, který vymyslel, je znázorněn na obrázku 7. Radioaktivní zdroj, který emituje záření alfa byla umístěna v olověném kontejneru s otvorem v jedné straně produkovat světlo alfa částic, které jsou typem ionizujícího záření katapultoval jádra radioaktivní zdroj., Do paprsku byla umístěna tenká zlatá fólie a rozptyl alfa částic byl pozorován záře, kterou způsobili, když zasáhli obrazovku fosforu.

obrázek 5. Rutherfordův experiment poskytl přímý důkaz o velikosti a hmotnosti jádra rozptýlením alfa částic z tenké zlaté fólie. Alfa částice s energií o 5MeV jsou emitovaných z radioaktivního zdroje (který je malý kovový kontejner, ve kterém se určité množství radioaktivního materiálu je uzavřená), jsou kolimovaný do paprsku, a na podzim na fólii., Počet částic, které pronikají do fólie nebo rozptylují do různých úhlů, naznačuje, že zlatá jádra jsou velmi malá a obsahují téměř celou hmotnost atomu zlata. To je zvláště indikováno alfa částicemi, které se rozptylují do velmi velkých úhlů, podobně jako fotbalový míč, který se odráží od hlavy brankáře.,
Alfa částice byly známé být dvojnásobně nabité pozitivní jádra atomy helia, které měl kinetické energie v řádu 5 MeV, když emitovány v radioaktivním rozpadu, které je rozpad jádra nestabilní nuklid spontánní emise nabitých částic. Tyto částice interagují s hmotou většinou Coulombovou silou a způsob, jakým se rozptylují z jader, může odhalit jadernou velikost a hmotnost. To je analogické pozorování, jak je bowlingová koule rozptýlena objektem, který přímo nevidíte., Protože alfa částice energie je tak velká, ve srovnání s typickou energií spojené s atomy (MeV versus eV), ty by se očekávat, že alfa částice jednoduše crash přes tenkou fólii, stejně jako nadzvukový bowling míč spadne přes několik desítek řádků kuželky. Thomson si představoval, že atom je malá koule, ve které bylo rovnoměrně rozloženo stejné množství kladného a záporného náboje. Incident masivní alfa částice by utrpěly pouze malé průhyby v takovém modelu., Místo toho Rutherford a jeho spolupracovníci zjistili, že částice alfa byly občas rozptýleny do velkých úhlů, některé dokonce Zpět ve směru, ze kterého přišli! Detailní analýza pomocí zachování hybnosti a energie—zejména malý počet, který přišel rovnou zpátky—naznačil, že zlato jádra jsou velmi malé ve srovnání s velikostí atom zlata, obsahují téměř všechny z atomu hmoty, a jsou pevně vázány. Od zlaté jádro je několikrát hmotnější než alfa částice, čelní náraz by rozptylu alfa částic přímo zpět směrem ke zdroji., Kromě toho, čím menší je jádro, tím méně alfa částic, které by zasáhly jednu hlavu.
ačkoli výsledky experimentu publikovali jeho kolegové v roce 1909, trvalo Rutherford dva roky, než se přesvědčil o svém významu. Stejně jako Thomson před ním se Rutherford zdráhal přijmout takové radikální výsledky. Příroda v malém měřítku je tak na rozdíl od našeho klasického světa, že i ti, kteří jsou v popředí objevu, jsou někdy překvapeni. Rutherford později napsal: „Bylo to skoro tak neuvěřitelné, jako kdybyste vystřelil 15palcovou skořápku na kus hedvábného papíru a vrátil se a zasáhl vás., Na zvážení jsem si uvědomil, že tento rozptyl zpět . . . . . . největší část hmotnosti atomu byla soustředěna v malém jádru.“
v roce 1911 publikoval Rutherford svou analýzu spolu s navrhovaným modelem atomu. Velikost jádra byla stanovena na asi 10-15 m, nebo 100 000 krát menší než atom. To znamená obrovskou hustotu v řádu 1015 g / cm3, na rozdíl od jakékoli makroskopické hmoty. Také naznačil, je existence dosud neznámé jaderné síly proti obrovské odpudivé Coulombovy síly mezi kladné náboje v jádře., Obrovské síly by také odpovídaly velkým energiím emitovaným v jaderném záření.

Obrázek 8. Rozšířený pohled na atomy ve zlaté fólii v Rutherfordově experimentu. Kruhy představují atomy (asi 10-10 m v průměru), zatímco tečky představují jádra (asi 10-15 m v průměru). Chcete-li být viditelné, tečky jsou mnohem větší než měřítko. Většina alfa částic prochází, ale je relativně neovlivněna kvůli jejich vysoké energii a malé hmotnosti elektronu., Někteří však míří přímo k jádru a jsou rozptýleni rovnou dozadu. Podrobná analýza dává velikost a hmotnost jádra.
malá velikost jádra také znamená, že atom je většinou prázdný uvnitř. Ve skutečnosti, v Rutherford experiment, většina alf šel rovnou přes zlaté fólie s velmi malý rozptyl, protože elektrony mají tak malou hmotnost, a protože atomu je většinou prázdný a nic pro alfa zasáhnout., V té době Rutherford provedl své experimenty, protože bylo pozorováno, že energetické elektrony pronikají tenkými fóliemi snadněji, než se očekávalo. Obrázek 8 ukazuje schéma atomů v tenké fólie s kruhy představující velikost atomů (asi 10-10 m) a tečky reprezentující jádra. (Tečky nemají měřítko-pokud by byly, budete potřebovat mikroskop, abyste je viděli.) Většina alfa částic chybí malá jádra a jsou jen mírně rozptýleny elektrony., Příležitostně (asi jednou v 8000 krát v Rutherfordově experimentu) alfa zasáhne jádro hlavou a je rozptýlena přímo dozadu.

obrázek 9. Rutherfordův planetární model atomu zahrnuje vlastnosti jádra, elektrony a velikost atomu. Tento model byl první, kdo rozpoznal strukturu atomů, ve kterých elektrony s nízkou hmotností obíhají velmi malé, masivní jádro v oběžných drahách mnohem větších než jádro. Atom je většinou prázdný a je analogický našemu planetárnímu systému.,
v závislosti na velikosti a hmotnosti jádra odhalila jeho pokus, stejně jako množství elektronů, Rutherford navrhl planetární model atomu. Planetární model atomu snímá nízko hmotnostní elektrony obíhající jádro s velkou hmotností. Velikosti elektronových oběžných drah jsou velké ve srovnání s velikostí jádra, s většinou vakuem uvnitř atomu. Tento obrázek je analogický tomu, jak planety s nízkou hmotností v naší sluneční soustavě obíhají Velké Slunce ve velkých vzdálenostech ve srovnání s velikostí slunce., V atomu je atraktivní Coulombova síla analogická gravitaci v planetárním systému. (Viz Obrázek 9.) Všimněte si, že pro vysvětlení experimentálních výsledků je zapotřebí model nebo mentální obraz, protože atom je příliš malý na to, aby byl přímo pozorován viditelným světlem.
Rutherford planetární model atomu byl zásadní pro pochopení vlastnosti atomů a jejich interakcí a energie, jak uvidíme v příštích několika sekcí. Také to bylo známkou toho, jak odlišná je povaha od známého klasického světa v malém kvantovém mechanickém měřítku., Objev spodku, aby se všechna hmota v podobě atomů a molekul, byla nyní učinila další krok odhalit vnitřní strukturu atomů, který byl jednodušší než 92 prvků, pak známý. Pokračovali jsme v hledání hlubších substruktur, jako jsou ty uvnitř jádra, s určitým úspěchem. V pozdějších kapitolách budeme sledovat tento úkol v diskusi o kvarcích a dalších elementárních částicích a podíváme se na směr, kterým se nyní zdá, že hledání směřuje.,
Phet Exploration: Rutherford Scattering
Jak Rutherford přišel na strukturu atomu, aniž by ho viděl? Simulovat slavný experiment, ve kterém vyvrátili, že vánoční Pudink model atomu pozorováním alfa částice se odráží od atomů a určení, že musí mít malé jádro.
Klikněte pro stažení simulace. Spustit pomocí Java.,
Oddíl Shrnutí
Problémy & Cvičení
- Rutherford zjistil, že velikost jádra mají být asi 10-15 m. To znamenalo obrovské hustoty. Co by tato hustota byla pro zlato?
- v milikanově experimentu s kapkou oleje se člověk dívá na malou kapku oleje, která je nehybná mezi dvěma deskami. Vezměte napětí mezi deskami na 2033 V a oddělení desky na 2,00 cm. Pokles oleje (o hustotě 0,81 g / cm3) má průměr 4,0 × 10-6 m. Najděte náboj na poklesu, pokud jde o elektronové jednotky. ,
- (a) ctižádostivý fyzik chce pro svůj projekt science fair vybudovat model atomu vodíku. Pokud má atom průměr 1,00 m, jak velká by se měla pokusit vytvořit jádro? b) jak snadné to bude dělat?