titrace odměrné technika, ve které řešení jednoho reaktantu (titrantu) se přidá k roztoku druhého reaktantu („analytu“) do ekvivalenčního bodu je dosaženo. Bod ekvivalence je bod, ve kterém byl titrant přidán přesně v správném množství, aby reagoval stechiometricky s analytenem (když moly titrantu = moly analytu). Pokud je titrant nebo analyt zbarven, bod ekvivalence je zřejmý ze zmizení barvy při konzumaci reakčních látek., V opačném případě může být přidán indikátor, který má „koncový bod“ (mění barvu) v bodě ekvivalence, nebo bod ekvivalence může být určen z titrační křivky. Množství přidaného titrantu je stanovena z jeho koncentrace a objem:
n (mol) = C (mol/L) * V (L)
a množství titrantu může být použit v obvyklém stechiometrický výpočet pro určení množství analytu.
proces titrace lze pozorovat ve videu níže.,
měření objemu roztoku k titraci, v tomto případě, bezbarvý vodný kyselina octová, CH3COOH(aq) je umístěn v kádince. Bezbarvý hydroxid sodný NaOH (aq), který je titrantem, se opatrně přidává pomocí buretu. Objem přidaného titrantu pak může být určen čtením hladiny kapaliny v buretu před a po titraci. Toto čtení lze obvykle odhadnout na nejbližší setinu mililitru, takže přesné přidání titrantu může být provedeno rychle.,
jako prvních několik mililitrů titrantu proudí do baňky, nějaký indikátor se krátce změní na růžovou, ale rychle se vrátí do bezbarvé. To je způsobeno velkým přebytkem kyseliny octové. Omezující činidlo NaOH je zcela spotřebováno.
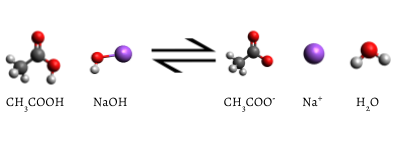
přidaný indikátor se po dokončení titrace změní na růžovou, což naznačuje, že veškerá vodná kyselina octová byla spotřebována NaOH(aq). Reakce, která nastane, je
nakonec se spotřebuje veškerá kyselina octová., Přidání dokonce i zlomek kapky titrantu vytváří trvalou růžovou barvu kvůli nezreagované NaOH v baňce. Změna barvy, ke které dochází v koncovém bodě indikátoru, signalizuje, že byla spotřebována veškerá kyselina octová, takže jsme dosáhli bodu ekvivalence titrace. Pokud by bylo přidáno o něco více roztoku NaOH, došlo by k přebytku a barva roztoku v baňce by byla mnohem tmavší. Koncový bod se objeví náhle a je třeba dbát na to, aby nedošlo k překročení koncového bodu.
po dosažení koncového bodu se z buretu přečte konečný objem., Pomocí počáteční a konečné čtení, přidaný objem lze určit poměrně přesně:
objekt titrace je vždy přidat jen množství titrantu potřeba konzumovat přesně to množství látky je titrována. V Eq reakce NaOH—CH3COOH. \(\ref{2}\), rovnovážný bod se objevuje při stejné molární množství NaOH byl přidán z odměrného válce, pro každý mol CH3COOH původně v titrační baňce., To znamená, že na rovnovážný bod poměr množství NaOH, přidaného množství CH3COOH spotřebované se musí rovnat stechiometrický poměr
\
Titrace se často používá ke stanovení koncentrace roztoku. V mnoha případech není jednoduché získat čistou látku, přesně ji zvážit a rozpustit v objemové baňce, jak tomu bylo v příkladu 1 koncentrací roztoku. Například NaOH se rychle kombinuje s H2O a CO2 ze vzduchu, a tak ani čerstvě připravený vzorek pevného NaOH nebude čistý., Jeho hmotnost by se měnila nepřetržitě, protože CO2(g) a H2O (g) byly absorbovány. Chlorovodík (HCl) je plyn při běžných teplotách a tlacích, což velmi ztěžuje manipulaci nebo vážení. Vodné roztoky obou těchto látek musí být standardizovány; to znamená, že jejich koncentrace musí být stanoveny titrací.
zdaleka nejčastější použití titrace je stanovení neznámých, které je při určování koncentrace nebo množství látky ve vzorku, o kterých jsme zpočátku nic nevěděl. Další příklad zahrnuje neznámé, s nimiž se každý den setkává mnoho lidí.,
308.0 mg získané v tomto příkladu je přiměřeně blízko dohodě s výrobcem je nárok 300 mg. Tablety jsou vyraženy stroji, nejsou váženy jednotlivě, a proto se očekává určitá variace.