Membranproteine
Während Lipide die grundlegenden Strukturelemente von Membranen sind,sind Proteine für die Ausführung spezifischer Membranfunktionen verantwortlich. Die meisten Plasmamembranen bestehen aus ungefähr 50% Lipid und 50% Protein nach Gewicht, wobei die Kohlenhydratanteile von Glycolipiden und Glykoproteinen 5 bis 10% der Membranmasse ausmachen. Da Proteine viel größer als Lipide sind, entspricht dieser Prozentsatz etwa einem Proteinmolekül pro 50 bis 100 Lipidmolekülen., Im Jahr 1972 schlugen Jonathan Singer und Garth Nicolson das Fluidmosaikmodell der Membranstruktur vor, das heute allgemein als grundlegendes Paradigma für die Organisation aller biologischen Membranen akzeptiert wird. In diesem Modell werden Membranen als zweidimensionale Flüssigkeiten betrachtet, in die Proteine in Lipiddoppelschichten eingeführt werden (Abbildung 12.3).

Abbildung 12.3
Fluidmosaikmodell der Plasmamembran., Integrale Membranproteine werden in die Lipiddoppelschicht eingeführt, während periphere Proteine indirekt durch Protein-Protein-Wechselwirkungen an die Membran gebunden werden. Die meisten integralen Membranproteine sind Transmembrane (mehr…)
Singer und Nicolson unterschieden zwei Klassen von membranassoziierten Proteinen, die sie periphere und integrale Membranproteine nannten., Periphere Membranproteine wurden operativ als Proteine definiert, die nach Behandlungen mit polaren Reagenzien, wie Lösungen mit extremem pH-Wert oder hoher Salzkonzentration, von der Membran dissoziieren und die Phospholipid-Doppelschicht nicht stören. Nach der Dissoziation von der Membran sind periphere Membranproteine in wässrigen Puffern löslich. Diese Proteine werden nicht in das hydrophobe Innere der Lipiddoppelschicht eingeführt. Stattdessen sind sie indirekt mit Membranen durch Protein-Protein-Wechselwirkungen verbunden., Diese Wechselwirkungen betreffen häufig Ionenbindungen, die durch extremen pH-Wert oder hohen Salzgehalt gestört werden.
Im Gegensatz zu den peripheren Membranproteinen können integrale Membranproteine nur durch Behandlungen freigesetzt werden, die die Phospholipid-Doppelschicht stören. Teile dieser integralen Membranproteine werden in die Lipiddoppelschicht eingeführt, so dass sie nur durch Reagenzien dissoziiert werden können, die hydrophobe Wechselwirkungen stören., Die am häufigsten verwendeten Reagenzien zur Solubilisierung von integralen Membranproteinen sind Detergenzien, bei denen es sich um kleine amphipathische Moleküle handelt, die sowohl hydrophobe als auch hydrophile Gruppen enthalten (Abbildung 12.4). Die hydrophoben Anteile von Detergenzien verdrängen die Membranlipide und binden an die hydrophoben Anteile integraler Membranproteine. Da das andere Ende des Waschmittelmoleküls hydrophil ist, sind die Waschmittel-Protein-Komplexe in wässrigen Lösungen löslich.

Abbildung 12.4
Solubilisierung integraler Membranproteine durch Detergenzien., Detergenzien (z. B. Octylglucosid) sind amphipathische Moleküle, die hydrophile Kopfgruppen und hydrophobe Schwänze enthalten. Die hydrophoben Schwänze binden an die hydrophoben Bereiche der Membran (mehr…)
Viele integrale Proteine sind Transmembranproteine, die sich über die Lipiddoppelschicht erstrecken, wobei Teile auf beiden Seiten der Membran freigelegt sind. Diese Proteine können in Elektronenmikrographen von Plasmamembranen visualisiert werden, die mit der Freeze-Fracture-Technik hergestellt wurden (siehe Abbildung 1.35). In diesen Proben wird die Membran gespalten und trennt sich in ihre beiden Blättchen., Transmembranproteine werden dann als Partikel auf den Innenflächen der Membran sichtbar (Abbildung 12.5).

Abbildung 12.5
Freeze-fracture electron micrograph of human red blood cell membranes. Die Partikel in der Membran sind Transmembranproteine. (Harold H. Edwards/Visuals Unlimited.,)
Die membranspannenden Anteile Transmembranproteine sind üblicherweise α-Helicles von 20 bis 25 hydrophoben Aminosäuren, die während der Synthese der Polypeptidkette in die Membran des endoplasmatischen Retikulums eingeführt werden (siehe Abbildungen 9.11, 9.12 und 9.13). Diese Proteine werden dann in Membranbläschen vom endoplasmatischen Retikulum zum Golgi-Apparat und von dort zur Plasmamembran transportiert., Kohlenhydratgruppen werden den Polypeptidketten sowohl im endoplasmatischen Retikulum als auch im Golgi-Apparat zugesetzt, so dass die meisten Transmembranproteine der Plasmamembran Glykoproteine sind, deren Oligosaccharide auf der Oberfläche der Zelle exponiert sind.
Studien an roten Blutkörperchen haben gute Beispiele für periphere und integrale Proteine geliefert, die mit der Plasmamembran assoziiert sind. Die Membranen menschlicher Erythrozyten enthalten etwa ein Dutzend Hauptproteine, die ursprünglich durch Gelelektrophorese von Membranpräparaten identifiziert wurden., Die meisten davon sind periphere Membranproteine, die als Bestandteile des kortikalen Zytoskeletts identifiziert wurden, das der Plasmamembran zugrunde liegt und die Zellform bestimmt (siehe Kapitel 11). Zum Beispiel ist das am häufigsten vorkommende periphere Membranprotein der roten Blutkörperchen Spectrin, das das wichtigste zytoskeletale Protein der Erythrozyten ist. Andere periphere Membranproteine der roten Blutkörperchen umfassen Aktin, Ankyrin und Bandagen., Ankyrin dient als Hauptverbindung zwischen der Plasmamembran und dem Zytoskelett, indem es sowohl an Spectrin als auch an das integrale Membranproteinband 3 bindet (siehe Abbildung 11.11). Eine zusätzliche Verbindung zwischen der Membran und dem Zytoskelett wird durch Band 4.1 hergestellt, das an die Verbindungen von Spectrin und Aktin sowie an Glycophorin (das andere wichtige integrale Membranprotein von Erythrozyten) bindet.
Die beiden wichtigsten integralen Membranproteine der roten Blutkörperchen, Glycophorin und Band 3, liefern gut untersuchte Beispiele für die Transmembranproteinstruktur (Abbildung 12.6)., Glycophorin ist ein kleines Glykoprotein von 131 Aminosäuren mit einem Molekulargewicht von etwa 30.000, von denen die Hälfte Protein und die Hälfte Kohlenhydrate ist. Glycophorin durchquert die Membran mit einer einzigen membranübergreifenden α-Helix von 23 Aminosäuren, wobei sein glykosylierter amino-terminaler Teil auf der Zelloberfläche freigelegt ist. Obwohl Glycophorin eines der ersten Transmembranproteine war, das charakterisiert wurde, bleibt seine genaue Funktion unbekannt. Im Gegensatz dazu ist die Funktion des anderen Haupttransmembranproteins der roten Blutkörperchen gut verstanden., Dieses Protein, ursprünglich als Band 3 bekannt, ist der Anionentransporter, der für die Passage von Bicarbonat – (HCO3 -) und Chlorid – (Cl -) Ionen durch die Membran der roten Blutkörperchen verantwortlich ist. Die Band-3-Polypeptidkette besteht aus 929 Aminosäuren und soll 14 membranspannende α-helikale Regionen aufweisen. Innerhalb der Membran bilden Dimere der Band 3 kugelförmige Strukturen, die interne Kanäle enthalten, durch die Ionen über die Lipiddoppelschicht wandern können.
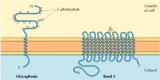
Abbildung 12.6
Integrale Membranproteine roter Blutkörperchen., Glycophorin (131 Aminosäuren) enthält eine einzelne Transmembran-α-helix. Es ist stark glyocosyliert, wobei Oligosaccharide an 16 Stellen im extrazellulären Teil der Polypeptidkette befestigt sind. (Mehr…)
Aufgrund ihres amphipathischen Charakters haben sich Transmembranproteine als schwierig zu kristallisieren erwiesen, wie es für die dreidimensionale Strukturanalyse durch Röntgenbeugung erforderlich ist., Das erste Transmembranprotein, das mittels Röntgenkristallographie analysiert wurde, war das photosynthetische Reaktionszentrum des Bakteriums Rhodopseudomonas viridis, über dessen Struktur 1985 berichtet wurde (Abbildung 12.7). Das Reaktionszentrum enthält drei Transmembranproteine, die entsprechend ihren durch Gelelektrophorese angegebenen scheinbaren Größen als L, M und H (leicht, mittel und schwer) bezeichnet werden. Die L-und M-Untereinheiten haben jeweils fünf membranspannende α-Helices. Die H-Untereinheit hat nur eine einzige Transmembran-α-Helix, wobei sich der Großteil der Polypeptidkette auf der zytosolischen Seite der Membran befindet., Die vierte Untereinheit des Reaktionszentrums ist ein Cytochrom, ein peripheres Membranprotein, das durch Protein-Protein-Wechselwirkungen an den Komplex gebunden ist.

Abbildung 12.7
Ein bakterielles photosynthetisches Reaktionszentrum. Das Reaktionszentrum besteht aus drei Transmembranproteinen, die als L (rot), M (gelb) und H (grün) bezeichnet werden. Die L-und M-Untereinheiten haben jeweils fünf Transmembran-α-Helices, während die H-Untereinheit nur (mehr…)
Obwohl die meisten Transmembranproteine die Membran durch α-helikale Regionen überspannen, ist dies nicht immer der Fall., Eine gut charakterisierte Ausnahme bilden die Porine—eine Klasse von Proteinen, die Kanäle in den äußeren Membranen einiger Bakterien bilden. Viele Bakterien, einschließlich E. coli, haben ein Doppelmembransystem, in dem die Plasmamembran (oder innere Membran) von der Zellwand und einer ausgeprägten äußeren Membran umgeben ist (Abbildung 12.8). Im Gegensatz zur Plasmamembran ist die äußere Membran hochdurchlässig für Ionen und kleine polare Moleküle (bei E. coli mit Molekulargewichten bis zu 600). Diese Permeabilität resultiert aus den Porinen, die durch die Lipiddoppelschicht offene wässrige Kanäle bilden., Wie in Kapitel 10 diskutiert, finden sich Proteine, die mit den bakteriellen Poren in Verbindung stehen, auch in den äußeren Membranen von Mitochondrien und Chloroplasten.
Abbildung 12.8
Bakterielle äußere Membranen. Die Plasmamembran einiger Bakterien ist von einer Zellwand und einer ausgeprägten äußeren Membran umgeben. Die äußere Membran enthält Porine, die offene wässrige Kanäle bilden, die den freien Durchgang von Ionen und kleinen Molekülen ermöglichen.
Die Strukturanalyse hat ergeben, dass die Porine keine hydrophoben α-helikalen Regionen enthalten., Stattdessen kreuzen sie die Membran als β-Fässer, in denen sich 16 β-Blätter zu einer tonnenartigen Struktur zusammenfalten, die eine wässrige Pore umschließt (Abbildung 12.9). Die Seitenketten polarer Aminosäuren säumen die Pore, während Seitenketten hydrophober Aminosäuren mit dem Inneren der Membran interagieren. Die Porinmonomere verbinden sich zu stabilen Trimern, von denen jeder drei offene Kanäle enthält, durch die polare Moleküle über die Membran diffundieren können.

Abbildung 12.9
Struktur einer porin monomer., Jedes Monomer ist ein β-Fass, das aus 16 antiparallelen β-Strängen (Pfeilen) besteht. Das obere Ende des Moleküls ist dem äußeren Medium zugewandt. (Aus H. Nikaido, 1994. J. Biol. Chem. 269: 3905.)
Im Gegensatz zu Transmembranproteinen sind eine Vielzahl von Proteinen (von denen sich viele als integrale Membranproteine verhalten) in der Plasmamembran durch kovalent angefügte Lipide oder Glycolipide verankert (Abbildung 12.10). Mitglieder einer Klasse dieser Proteine werden durch Glykosylphosphatidylinositolanker (GPI) in die äußere Packungsbeilage der Plasmamembran eingeführt., GPI-Anker werden bestimmten Proteinen zugesetzt, die in das endoplasmatische Retikulum übertragen wurden und durch eine C-terminale Transmembranregion in der Membran verankert sind (siehe Abbildung 9.16). Die Transmembranregion wird gespalten, wenn der GPI-Anker hinzugefügt wird, so dass diese Proteine nur durch das Glycolipid an der Membran haften bleiben. Da die Polypeptidketten von GPI-verankerten Proteinen in das endoplasmatische Retikulum übertragen werden, werden sie glykosyliert und auf der Oberfläche der Zelle nach dem Transport zur Plasmamembran freigelegt.
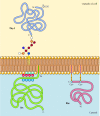
Abbildung 12.,10
Beispiele für Proteine, die in der Plasmamembran durch Lipide und Glycolipide verankert sind. Einige Proteine (z. B. das Lymphozytenprotein Thy-1) werden in der äußeren Packungsbeilage der Plasmamembran durch GPI-Anker verankert, die ihrem C-Terminus im endoplasmatischen Retikulum zugesetzt werden. (Mehr…)
Andere Proteine sind in der inneren Packungsbeilage der Plasmamembran durch kovalent angebrachte Lipide verankert. Anstatt über den sekretorischen Weg verarbeitet zu werden, werden diese Proteine auf freien cytosolischen Ribosomen synthetisiert und dann durch Zugabe von Lipiden modifiziert., Diese Modifikationen umfassen die Zugabe von Myristinsäure (einer 14-Kohlenstoff-Fettsäure) zum Aminoterminus der Polypeptidkette, die Zugabe von Palmitinsäure (16 Kohlenstoff) zu den Seitenketten von Cysteinresten und die Zugabe von Prenylgruppen (15 oder 20 Kohlenstoff) zu den Seitenketten von carboxy-terminalen Cysteinresten (siehe Abbildungen 7.29, 7.30 und 7.31). In einigen Fällen werden diese Proteine (von denen sich viele als periphere Membranproteine verhalten) durch positiv geladene Regionen der Polypeptidkette sowie durch die angeschlossenen Lipide auf die Plasmamembran gerichtet., Diese positiv geladenen Proteindomänen können mit den negativ geladenen Kopfgruppen von Phosphatidylserin auf der zytosolischen Fläche der Plasmamembran interagieren. Es ist bemerkenswert, dass viele der in der inneren Packungsbeilage der Plasmamembran verankerten Proteine (einschließlich der in Abbildung 12.10 dargestellten Src-und Ras-Proteine) eine wichtige Rolle bei der Übertragung von Signalen von Zelloberflächenrezeptoren auf intrazelluläre Ziele spielen, wie im nächsten Kapitel erläutert.