Eine Titration ist eine volumetrische Technik, bei der einer Lösung eines Reaktanten (des Titranten) eine Lösung eines zweiten Reaktanten (des „Analyten“) zugesetzt wird, bis der Äquivalenzpunkt erreicht ist. Der Äquivalenzpunkt ist der Punkt, an dem der Titrant genau in der richtigen Menge hinzugefügt wurde, um stöchiometrisch mit dem Analyten zu reagieren (wenn Molen des Titranten = Molen des Analyten). Wenn entweder der Titrant oder der Analyt gefärbt ist, zeigt sich der Äquivalenzpunkt aus dem Verschwinden der Farbe, wenn die Reaktanten verbraucht werden., Andernfalls kann ein Indikator hinzugefügt werden, der am Äquivalenzpunkt einen „Endpunkt“ (Farbwechsel) aufweist, oder der Äquivalenzpunkt kann aus einer Titrationskurve bestimmt werden. Die Menge des zugesetzten Titranten wird aus seiner Konzentration und seinem Volumen bestimmt:
n (mol) = C (mol/L) * V (L)
und die Menge des Titranten kann in der üblichen stöchiometrischen Berechnung verwendet werden, um die Menge des Analyten zu bestimmen.
Der Titrationsprozess kann im folgenden Video beobachtet werden.,
Ein gemessenes Volumen der zu titrierenden Lösung, in diesem Fall farblose wässrige Essigsäure, CH3COOH(aq), wird in ein Becherglas gegeben. Das farblose Natriumhydroxid NaOH(aq), das der Titrant ist, wird vorsichtig mittels eines Burets zugegeben. Das Volumen des zugesetzten Titranten kann dann durch Ablesen des Flüssigkeitsgehalts im Buret vor und nach der Titration bestimmt werden. Dieser Wert kann normalerweise auf das nächste Hundertstel Milliliter geschätzt werden, so dass genaue Zusätze des Titranten schnell vorgenommen werden können.,
Wenn die ersten Milliliter Titrant in den Kolben fließen, ändert sich ein Indikator kurz in Rosa, kehrt jedoch schnell zu farblos zurück. Dies ist auf einen großen Überschuss an Essigsäure zurückzuführen. Das limitierende Reagenz NaOH wird vollständig verbraucht.
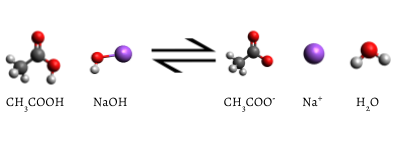
Der hinzugefügte Indikator ändert sich nach Abschluss der Titration in Rosa, was darauf hinweist, dass die gesamte wässrige Essigsäure von NaOH(aq) verbraucht wurde. Die Reaktion, die Auftritt, ist
\
Schließlich alle die Essigsäure verbraucht wird., Die Zugabe von nur einem Bruchteil eines Titrantentropfens erzeugt eine anhaltende rosa Farbe aufgrund von nicht umgesetztem NaOH im Kolben. Die Farbänderung, die am Endpunkt des Indikators auftritt, signalisiert, dass die gesamte Essigsäure verbraucht wurde, sodass wir den Äquivalenzpunkt der Titration erreicht haben. Wenn etwas mehr NaOH-Lösung hinzugefügt würde, gäbe es einen Überschuss und die Farbe der Lösung im Kolben würde viel dunkler werden. Der Endpunkt erscheint plötzlich und es muss darauf geachtet werden, den Endpunkt nicht zu überschreiben.
Nachdem die Titration den Endpunkt erreicht hat, wird ein Endvolumen aus dem Buret ausgelesen., Mit der Anfangs-und Endlesung kann das hinzugefügte Volumen ganz genau bestimmt werden:
Ziel einer Titration ist es immer, genau die Menge an Titrant hinzuzufügen, die benötigt wird, um genau die Menge der titrierten Substanz zu verbrauchen. In der NaOH-CH3COOH Reaktion Eq. \(\ref{2}\), der Äquivalenzpunkt tritt auf, wenn für jeden Mol CH3COOH, der sich ursprünglich im Titrationskolben befand, eine gleiche Molmenge NaOH aus dem Messzylinder zugegeben wurde., Das heißt, am Äquivalenzpunkt muss das Verhältnis der Menge an NaOH, die zu der Menge an verbrauchtem CH3COOH hinzugefügt wird, dem stöchiometrischen Verhältnis entsprechen
\
Titration wird häufig verwendet, um die Konzentration einer Lösung zu bestimmen. In vielen Fällen ist es nicht einfach, eine reine Substanz zu erhalten, genau zu wiegen und in einem volumetrischen Kolben aufzulösen, wie dies in Beispiel 1 der Lösungskonzentrationen der Fall war. NaOH verbindet sich beispielsweise schnell mit H2O und CO2 aus der Luft, so dass selbst eine frisch zubereitete Probe fester NaOH nicht rein ist., Sein Gewicht würde sich kontinuierlich ändern, wenn CO2(g) und H2O (g) absorbiert würden. Chlorwasserstoff (HCl) ist ein Gas bei gewöhnlichen Temperaturen und Drücken, was es sehr schwierig macht, damit umzugehen oder zu wiegen. Wässrige Lösungen beider Substanzen müssen standardisiert werden, dh ihre Konzentrationen müssen durch Titration bestimmt werden.
Die bei weitem häufigste Verwendung von Titrationen besteht in der Bestimmung von Unbekannten, dh in der Bestimmung der Konzentration oder Menge der Substanz in einer Probe, von der wir anfangs nichts wussten. Das nächste Beispiel beinhaltet ein Unbekanntes, dem viele Menschen jeden Tag begegnen.,
Die in diesem Beispiel erhaltenen 308,0 mg stimmen mit dem Herstelleranspruch von 300 mg einigermaßen überein. Die Tabletten werden maschinell herausgestanzt, nicht einzeln gewogen, so dass eine gewisse Variation erwartet wird.