Hintergrund der D/L-Notation
Das d/l-System (benannt nach Latin dexter und laevus, rechts und links) benennt Moleküle, indem es sie mit dem Molekül Glyceraldehyd in Beziehung setzt. Glyceraldehyd ist chiral und seine beiden Isomere sind mit d und l gekennzeichnet (typischerweise in kleinen Kappen in veröffentlichten Arbeiten)., Bestimmte chemische Manipulationen können an Glyceraldehyd durchgeführt werden, ohne seine Konfiguration zu beeinflussen, und seine historische Verwendung für diesen Zweck (möglicherweise kombiniert mit seiner Bequemlichkeit als eines der kleinsten häufig verwendeten chiralen Moleküle) hat zu seiner Verwendung für die Nomenklatur geführt. In diesem System werden Verbindungen analog zu Glyceraldehyd benannt, das im Allgemeinen eindeutige Bezeichnungen erzeugt, aber in den kleinen Biomolekülen ähnlich wie Glyceraldehyd am einfachsten zu sehen ist., Ein Beispiel ist die chirale Aminosäure Alanin, die zwei optische Isomere aufweist, und sie sind entsprechend gekennzeichnet, aus welchem Isomer von Glyceraldehyd sie stammen. Andererseits hat Glycin, die aus Glyceraldehyd gewonnene Aminosäure, keine optische Aktivität, da es nicht chiral (achiral) ist.
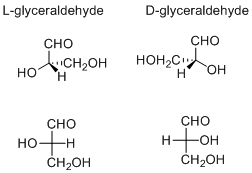
Die d/l Kennzeichnung nicht zu (+)/(−); es bedeutet jedoch nicht, welches enantiomer ist die rechtsdrehende und die linksdrehende., Vielmehr besagt es, dass die Stereochemie der Verbindung mit der des dextrorotatorischen oder levorotatorischen Enantiomers von Glyceraldehyd zusammenhängt—das dextrorotatorische Isomer von Glyceraldehyd ist in der Tat das d – Isomer. Neun der neunzehn l-Aminosäuren, die üblicherweise in Proteinen sind rechtsdrehende (bei einer Wellenlänge von 589 nm) und d-fructose wird auch bezeichnet als levulose, weil es linksdrehende.